Слайд 2Сера
Се́ра — элемент главной подгруппы VI группы третьего периода периодической системы химических

элементов Д. И. Менделеева, с атомным номером 16. Неметалл. Обозначается символом S (лат. sulfur). В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
Слайд 3Физические свойства серы
Сера представляет собой твердое хрупкое вещество желтого цвета, в воде
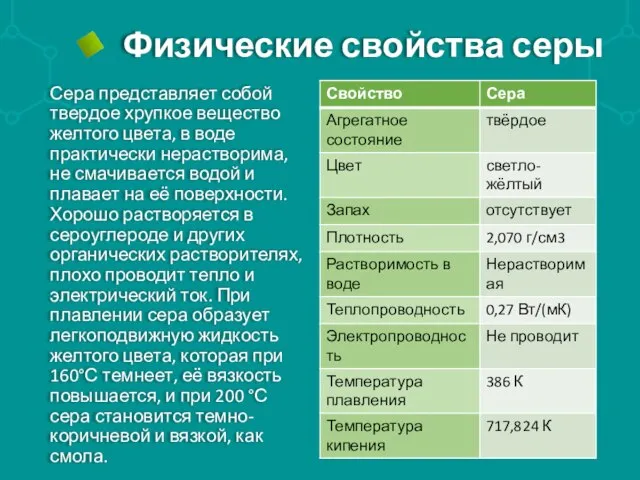
практически нерастворима, не смачивается водой и плавает на её поверхности. Хорошо растворяется в сероуглероде и других органических растворителях, плохо проводит тепло и электрический ток. При плавлении сера образует легкоподвижную жидкость желтого цвета, которая при 160°С темнеет, её вязкость повышается, и при 200 °С сера становится темно-коричневой и вязкой, как смола.
Слайд 4Химические свойства серы
На воздухе сера горит, образуя сернистый газ — бесцветный газ

с резким запахом.
Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только со фтором.
Расплав серы реагирует с хлором, при этом возможно образование двух низших хлоридов (дихлорид серы и дитиодихлорид).
При избытке серы также образуются разнообразные дихлориды полисеры типа SnCl2.
Слайд 5При нагревании сера также реагирует с фосфором, образуя смесь сульфидов фосфора, среди

которых — высший сульфид P2S5.
Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием.
При нагревании сера взаимодействует со многими металлами, часто — весьма бурно. Иногда смесь металла с серой загорается при поджигании. При этом взаимодействии образуются сульфиды.
Слайд 6Растворы сульфидов щелочных металлов реагируют с серой с образованием полисульфидов.
Из сложных веществ
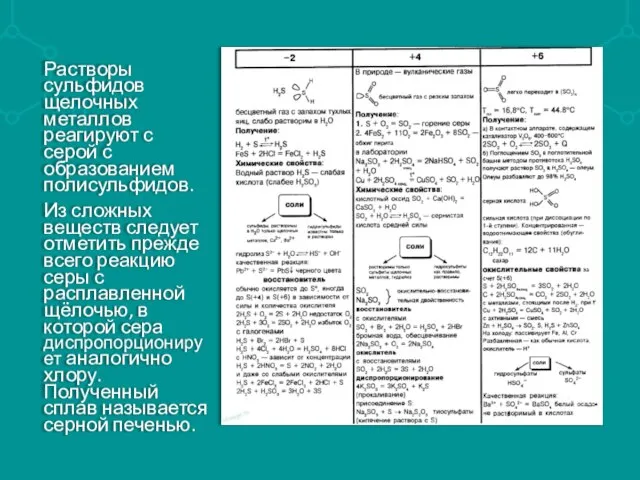
следует отметить прежде всего реакцию серы с расплавленной щёлочью, в которой сера диспропорционирует аналогично хлору. Полученный сплав называется серной печенью.
Слайд 7С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании.
При увеличении

температуры в парах серы происходят изменения в количественном молекулярном составе. Число атомов в молекуле уменьшается.
Слайд 8Применение
Примерно половина производимой серы используется в производстве серной кислоты.
Серу применяют для вулканизации
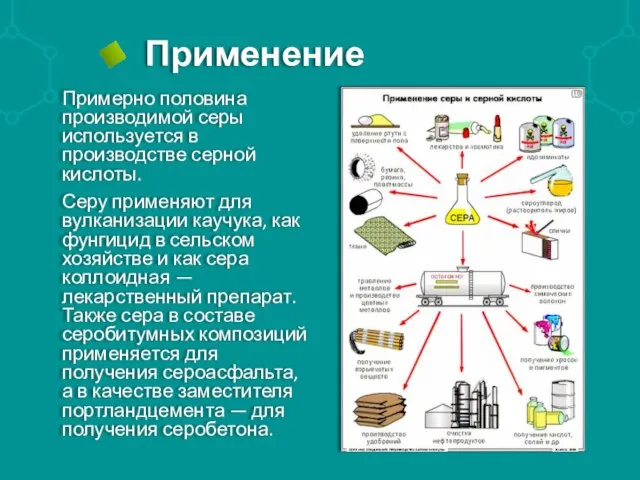
каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона.
Слайд 9Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха,

применяется для производства спичек. Серная лампа — источник белого света, очень близкого к солнечному, с высоким КПД.








 Химическая связь и строение вещества
Химическая связь и строение вещества lektsia_6 (1)
lektsia_6 (1) Основы квантовой химии
Основы квантовой химии Презентация по Химии "Законы газового состояния вещества"
Презентация по Химии "Законы газового состояния вещества"  Алканы
Алканы Эксперимент с духами
Эксперимент с духами Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли
Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли Презентация на тему "Азотная кислота"
Презентация на тему "Азотная кислота" Что такое электрон?
Что такое электрон? Химия — это наука о веществах, их свойствах и превращениях
Химия — это наука о веществах, их свойствах и превращениях Цикл фосфора (окончание). Цикл в реках и в море
Цикл фосфора (окончание). Цикл в реках и в море Производные салициловой, пара-аминобензойной кислот, применяемые в медицине
Производные салициловой, пара-аминобензойной кислот, применяемые в медицине Виды химических связей
Виды химических связей Влияние различных факторов на скорость химических реакций
Влияние различных факторов на скорость химических реакций Валентность
Валентность Азотосодержащие соединения: Амины. Аминокислоты. Белки
Азотосодержащие соединения: Амины. Аминокислоты. Белки Щелочные металлы и их соединения
Щелочные металлы и их соединения Природные источники углеводородов. Нефть и природный газ
Природные источники углеводородов. Нефть и природный газ Ископаемые углеводороды
Ископаемые углеводороды Элемент астат
Элемент астат Кристаллы. Виды
Кристаллы. Виды Строение атома. Связь основных характеристик атома с его положением в таблице Д.И. Менделеева. Способы изображения строения
Строение атома. Связь основных характеристик атома с его положением в таблице Д.И. Менделеева. Способы изображения строения Классификация химических реакций
Классификация химических реакций КВН по теме: Периодическая система химических элементов Д.И. Менделеева
КВН по теме: Периодическая система химических элементов Д.И. Менделеева Введение в органическую химию
Введение в органическую химию Онлайн-школа подготовки к ЕГЭ по химии CharChem
Онлайн-школа подготовки к ЕГЭ по химии CharChem Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро
Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро Соли. Для учащихся 8 класса
Соли. Для учащихся 8 класса