Содержание
- 16. Корро́зия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического или физико-химического
- 17. КОРРОЗИЯ – Это окислительно-восстановительная реакция, при которой атомы металла превращаются в ионы. Чем активнее металл, тем
- 18. Химически чистое железо не ржавеет, т.к. не содержит примесей Индия, Новый Дели, Железный столб 1 в
- 19. ЗНАЧЕНИЕ КОРРОЗИИ Вызывает серьезные экологические последствия: утечка нефти, газа, других химических продуктов. Недопустима во многих отраслях
- 20. ФАКТОРЫ, ВЫЗЫВАЮЩИЕ КОРРОЗИЮ Кислород и влага атмосферы Углекислый и сернистый газы, содержащиеся в атмосфере Морская вода
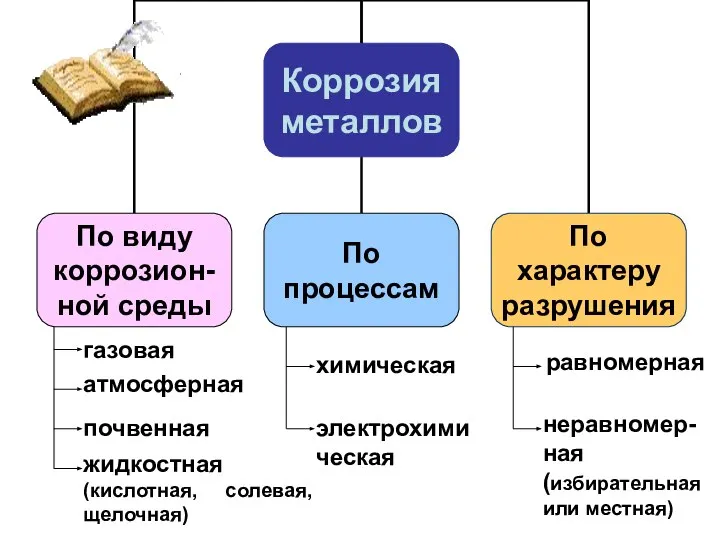
- 21. газовая атмосферная почвенная жидкостная (кислотная, солевая, щелочная) химическая электрохимическая равномерная неравномер- ная (избирательная или местная)
- 22. ХИМИЧЕСКАЯ – это разрушение металлов и сплавов в результате их химического взаимодействия с веществами окружающей среды.
- 23. Химическая коррозия Этот вид коррозии наблюдается в процессе обработки металлов при высоких температурах. Протекают окислительно-восстановительные химические
- 24. Примеры химической коррозии: Fe + O2 ? Fe3O4 Fe + Cl2 ? FeCl3 Cu ? CuO
- 25. ХИМИЧЕСКАЯ КОРРОЗИЯ
- 26. ЭЛЕКТРОХИМИЧЕСКАЯ – это разрушение металлов, которое сопровождается возникновением электрического тока в воде или среде другого электролита.
- 27. Электрохимическая коррозия Процесс происходит при соприкосновении двух металлов или на поверхности металла, содержащего включения. Более активный
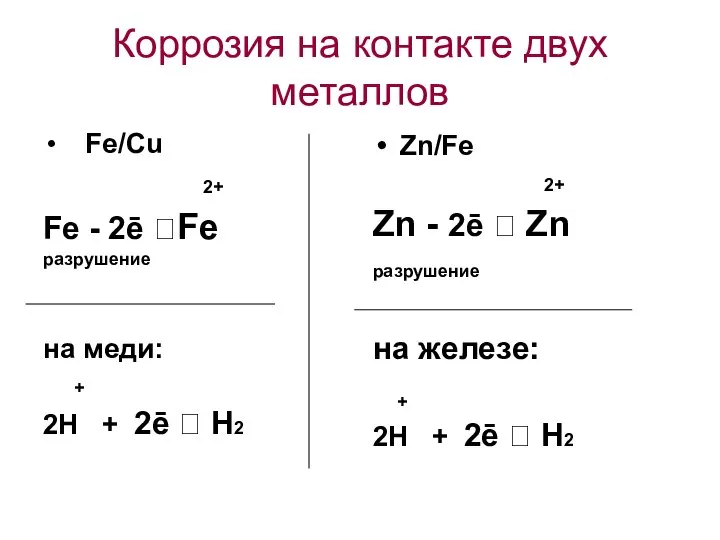
- 28. Коррозия на контакте двух металлов Fe/Cu 2+ Fe - 2ē ?Fe разрушение на меди: + 2Н
- 29. УСЛОВИЯ, СПОСОБСТВУЮЩИЕ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ Положение металла в ряду активности металлов: чем они дальше расположены друг от
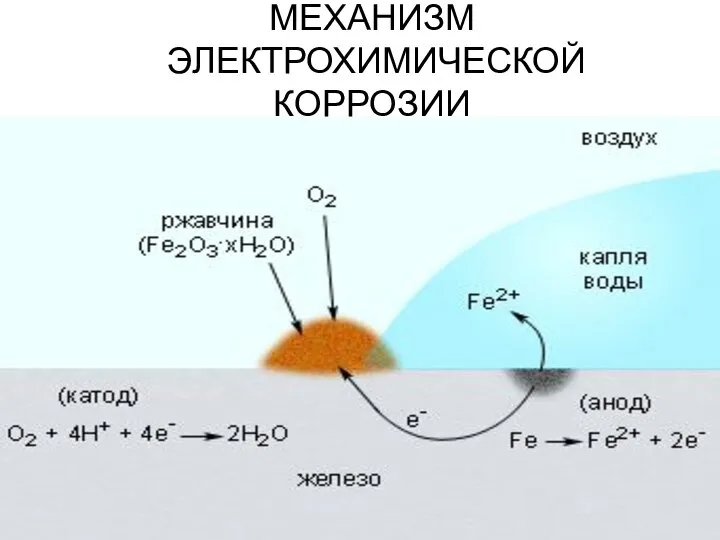
- 30. МЕХАНИЗМ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
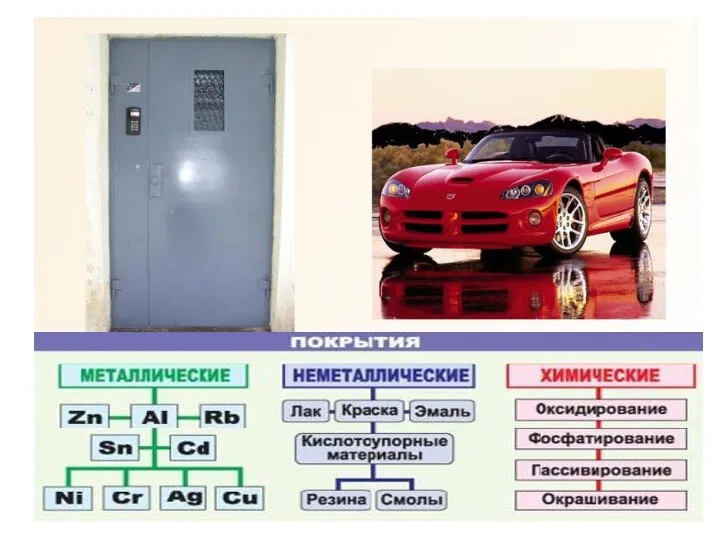
- 31. Способы защиты от коррозии
- 33. Электрохимические методы защиты Катодная защита Металлоконструкцию подсоединяют к катоду внешнего источника тока, что исключает возможность её
- 34. Шлифование поверхностей изделия Поверхности шлифуют, чтобы на них не задерживалась влага. Применение легированных сплавов Они содержат
- 35. СПОСОБЫ ЗАЩИТЫ ОТ КОРРОЗИИ Нанесение защитных покрытий (лаки, краски, эмали); Покрытие другим металлом (позолота, серебрение, хромирование,
- 36. Введение в среду ингибиторов, снижающих агрессивность среды; В некоторых случаях пигменты красок выполняют также роль ингибиторов
- 38. Скачать презентацию































 Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Применение алкенов
Применение алкенов Цикл фосфора (окончание). Цикл в реках и в море
Цикл фосфора (окончание). Цикл в реках и в море Предельные углеводороды Алканы
Предельные углеводороды Алканы Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи
Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Презентация на тему Теория А. М. Бутлерова
Презентация на тему Теория А. М. Бутлерова  Стехиометрические законы химии
Стехиометрические законы химии Химия элементов неметаллов. Сера
Химия элементов неметаллов. Сера Строение атома. Планетарная модель атома Резерфорда
Строение атома. Планетарная модель атома Резерфорда Минералы
Минералы Геометрия молекул
Геометрия молекул Предмет химии. Вещества
Предмет химии. Вещества Круговорот серы в природе
Круговорот серы в природе Физичекие явления - основа разделения смесей в химии. 17.09.21
Физичекие явления - основа разделения смесей в химии. 17.09.21 Углеродные материалы. Основные понятия и определения. Области их применения
Углеродные материалы. Основные понятия и определения. Области их применения Презентация на тему Химия и стирка
Презентация на тему Химия и стирка  Железо и его соединения
Железо и его соединения Спирты и фенолы
Спирты и фенолы Решение задач
Решение задач Физические явления. Способы разделения смесей
Физические явления. Способы разделения смесей Разбор контрольной работы. Химия (9 класс)
Разбор контрольной работы. Химия (9 класс) Презентация на тему Важнейшие классы неорганических соединений
Презентация на тему Важнейшие классы неорганических соединений  Коррозия металлов. Лекция №8
Коррозия металлов. Лекция №8 Арены. Бензол
Арены. Бензол Химические элементы. Викторина
Химические элементы. Викторина Салқындатқыш агенттер және оларды салқындату әдістері
Салқындатқыш агенттер және оларды салқындату әдістері Буферные системы
Буферные системы