Содержание
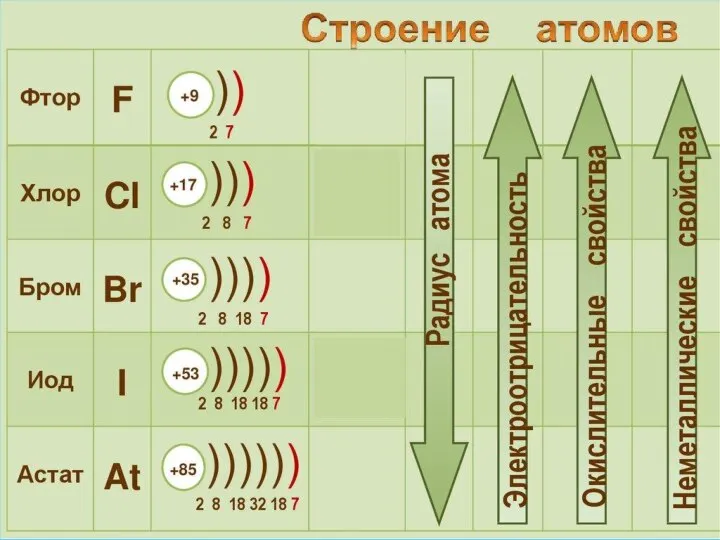
- 5. Физические свойства F2
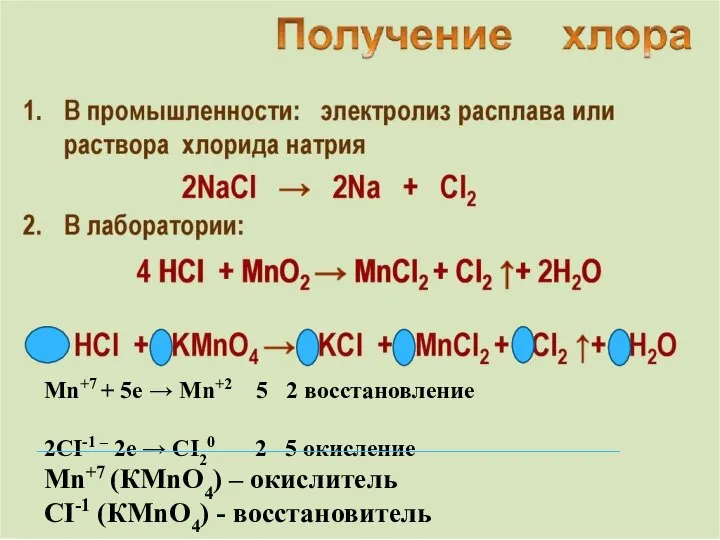
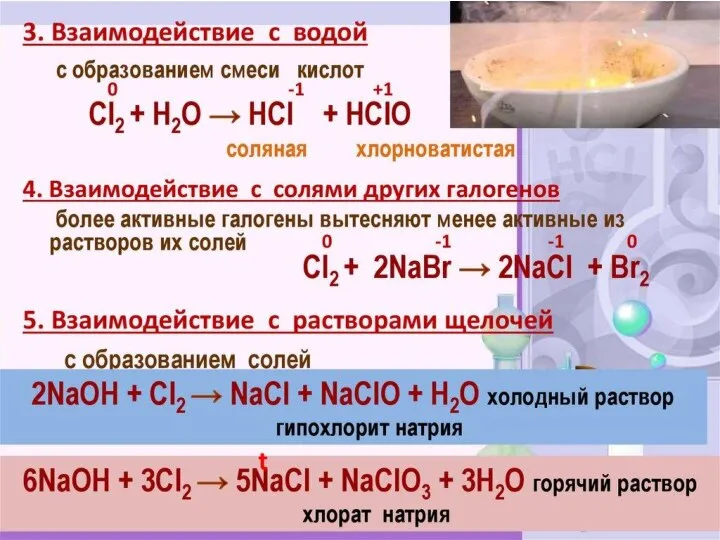
- 6. Mn+7 + 5e → Mn+2 5 2 восстановление 2CI-1 – 2e → CI20 2 5 окисление
- 7. 2NaCI + 2H2O = 2NaOH + CI2↑ + H2↑ NaCI + H2O = электролиз
- 11. С простыми веществами: С металлами С неметаллами Fe + Cl2 → H2 + Cl2 → Cu
- 12. С простыми веществами: С металлами С неметаллами 2Fe + 3Cl2 → 2FeCl3 H2 + Cl2 →
- 13. С простыми веществами: С металлами С неметаллами Al + Br2 → H2 + Br2 → Cu
- 14. С простыми веществами: С металлами С неметаллами 2Al + 3Br2 → 2AlBr3 H2 + Br2 →
- 15. С простыми веществами: С металлами С неметаллами Hg + I2 → H2 + I2 → Al
- 16. С простыми веществами: С металлами С неметаллами Hg + I2 → HgI2 H2 + I2 →
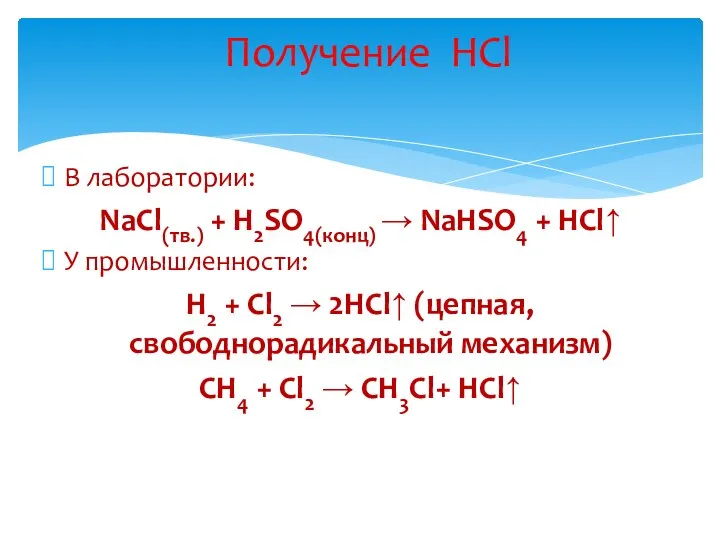
- 17. В лаборатории: NaCl(тв.) + H2SO4(конц) → NaHSO4 + HCl↑ У промышленности: H2 + Cl2 → 2HCl↑
- 24. Химические свойства галогенов Найди соответствие между исходными веществами и продуктами реакций Xe + 2F2 = H2
- 25. Домашнее задание: 1) Пройти лекцию в ИОС (Химия. 2 курс) «Галогены. Положение в периодической системе химических
- 28. Скачать презентацию
















 Скорость химической реакции и химическое равновесие. Задание 20 в ЕГЭ
Скорость химической реакции и химическое равновесие. Задание 20 в ЕГЭ Аминокислоты. Классификация, номенклатура
Аминокислоты. Классификация, номенклатура Полистирол. Оформление мини-реферата по химии
Полистирол. Оформление мини-реферата по химии Основания, их классификация и свойства
Основания, их классификация и свойства Кинетика гомогенных реакций
Кинетика гомогенных реакций Фенол. Классификация фенолов
Фенол. Классификация фенолов Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Круговорот серы в природе
Круговорот серы в природе Кислород. Нахождение в природе. Свойства. 8 класс
Кислород. Нахождение в природе. Свойства. 8 класс Анализ углеводов в пищевых продуктах
Анализ углеводов в пищевых продуктах Анализ образца доломита методами аналитической химии
Анализ образца доломита методами аналитической химии Альфа и бета распад. Правило смещения
Альфа и бета распад. Правило смещения Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Будова електронних оболонок і властивості хіиічних елементів. (8 клас)
Будова електронних оболонок і властивості хіиічних елементів. (8 клас) Выращивание кристаллов соли (домашний эксперимент)
Выращивание кристаллов соли (домашний эксперимент) Химические реакции в органической химии
Химические реакции в органической химии Химиялық қоспалар
Химиялық қоспалар Чистые вещества и смеси. Использование химического анализа
Чистые вещества и смеси. Использование химического анализа Гидролиз солей – частный случай РИО
Гидролиз солей – частный случай РИО Реакции ионного обмена
Реакции ионного обмена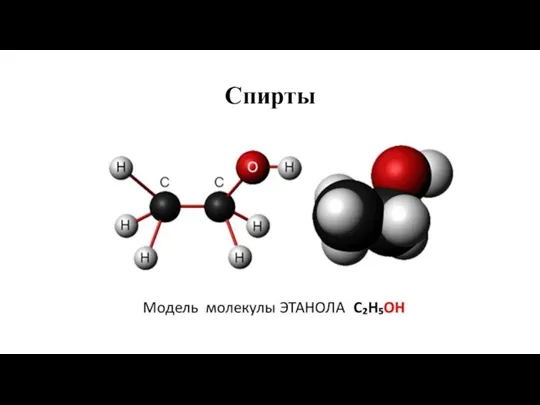 Спирты
Спирты Консультация. Дисциплина Биоорганическая химия
Консультация. Дисциплина Биоорганическая химия Влияние метилового спирта на организм человека
Влияние метилового спирта на организм человека Logo кроссворд первоначальные понятия. 8 класс
Logo кроссворд первоначальные понятия. 8 класс Предельные углеводороды - алканы
Предельные углеводороды - алканы Генетичні зв’язки між неорганічними речовинами
Генетичні зв’язки між неорганічними речовинами Простые вещества в стране Химляндии. 8 класс
Простые вещества в стране Химляндии. 8 класс Превращения вещества
Превращения вещества