Содержание
- 2. ТЕСТ Вариант 1. 1. Однородная система, состоящая из частиц растворѐнного вещества, растворителя и продуктов их взаимодействия:
- 3. Вариант 1. 1. Б 2. А 3. В 4. В 5. А, В, Г Вариант 2.
- 4. В конце XIX века шведский химик Сванте Аррениус проводил исследование различных растворов по отношению к электрическому
- 5. Электролитическая диссоциация
- 6. Цель урока: 1. Изучить понятия электролиты и неэлектролиты. 2. Рассмотреть механизм электролититической диссоциации веществ
- 7. Вещества, растворы которых проводят электрический ток, называются электролитами. Вещества, растворы которых не проводят электрический ток, называются
- 8. Электролитическая диссоциация - процесс распада молекул электролита на ионы в растворе или расплаве. 1887 г. -
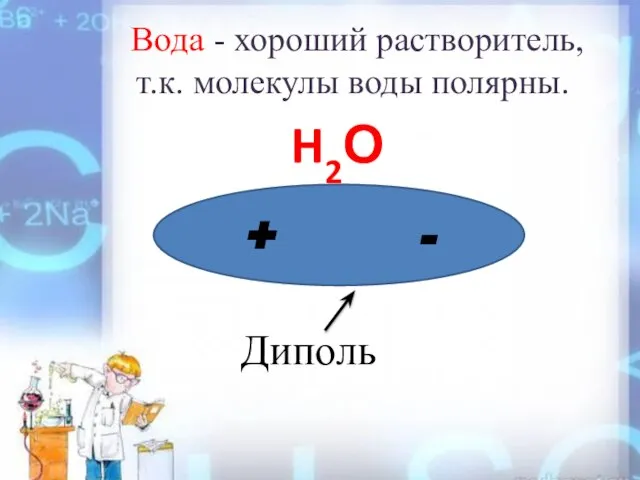
- 9. Вода - хороший растворитель, т.к. молекулы воды полярны. + - H2О Диполь
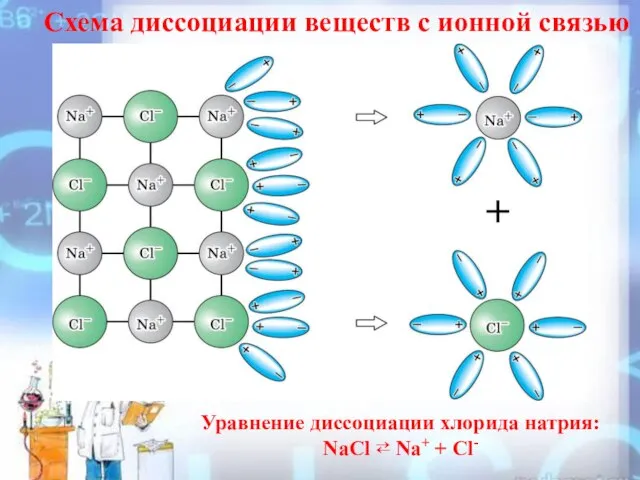
- 10. Схема диссоциации веществ с ионной связью Уравнение диссоциации хлорида натрия: NaCl ⇄ Na+ + Cl-
- 11. Степень электролитической диссоциации - это отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе.
- 12. Классификация электролитов по степени электролитической диссоциации Сильные электролиты Слабые электролиты ●все соли ●слабые кислоты ●сильные кислоты
- 13. Положения ТЭД: 1. Электролиты в растворах и расплавах диссоциируют на ионы. 2. Диссоциация – обратимый процесс.
- 14. Составьте уравнения диссоциации для веществ, являющихся сильными электролитами. В1. AgNO3, HBr, Fe(OH)2 В2. HI, PbBr2, H2SiO3
- 15. В1. AgNO3 ⇄ Ag+ + NO3- HBr ⇄ H+ + Br- В2. HI ⇄ H+ +
- 16. Домашнее задание : На 3 - параграф 35, выучить конспект в тетради. На 4 - параграф
- 17. Рефлексия
- 19. Скачать презентацию














 Химические свойства оснований
Химические свойства оснований Презентация по Химии "Классификация реакций в неорганической химии"
Презентация по Химии "Классификация реакций в неорганической химии"  Строение металлов и их сплавов
Строение металлов и их сплавов Химический состав клетки. Урок биологии в 10 классе
Химический состав клетки. Урок биологии в 10 классе Презентация на тему Уксусная кислота
Презентация на тему Уксусная кислота  lll-l группы главные подгруппы. 11 класс
lll-l группы главные подгруппы. 11 класс 热塑性复合材料的分类及特性
热塑性复合材料的分类及特性 Загадки химии. Занятие 4
Загадки химии. Занятие 4 Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік
Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік Многоатомные спирты
Многоатомные спирты Электрохимия. Электролиты
Электрохимия. Электролиты Производство полимеров в РК
Производство полимеров в РК Типы химических реакций. 8 класс
Типы химических реакций. 8 класс Закон сохранения массы веществ. Уравнения химических реакций.
Закон сохранения массы веществ. Уравнения химических реакций. Презентация на тему Применение радиоактивных изотопов в археологии
Презентация на тему Применение радиоактивных изотопов в археологии  Валентность химических элементов
Валентность химических элементов Природные источники углеводородов
Природные источники углеводородов Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В.
Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В. Методы анализа структуры белка
Методы анализа структуры белка Общая характеристика металлов
Общая характеристика металлов Химическая шкатулка
Химическая шкатулка Применение алкенов
Применение алкенов Предпосылки открытия Периодического закона Д. И. Менделеевым
Предпосылки открытия Периодического закона Д. И. Менделеевым Неметаллы IV-VI групп
Неметаллы IV-VI групп Лекция 3
Лекция 3 Электролиз и его применение
Электролиз и его применение MPKh_PREZENTATsIYa_2
MPKh_PREZENTATsIYa_2 Валентность (7 класс)
Валентность (7 класс)