Содержание
- 2. ОЛОВО
- 3. Sn – олово. Порядковый номер 50, находится в IV группе, в главной подгруппе, p-элемент. Относительная атомная
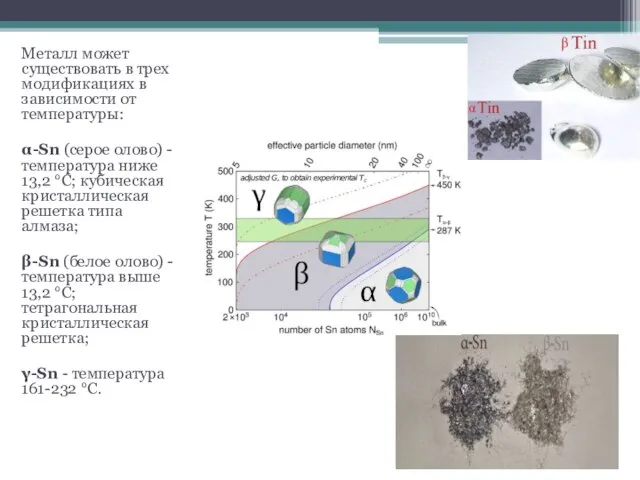
- 4. Металл может существовать в трех модификациях в зависимости от температуры: α-Sn (серое олово) - температура ниже
- 5. История открытия Олово было известно человеку уже в IV тысячелетии до н. э. Этот металл был
- 7. Нахождение в природе Олово — редкий рассеянный элемент, по распространённости в земной коре олово занимает 47-е
- 8. Мировые месторождения олова находятся в основном в Китае и Юго-Восточной Азии — Индонезии, Малайзии и Таиланде.
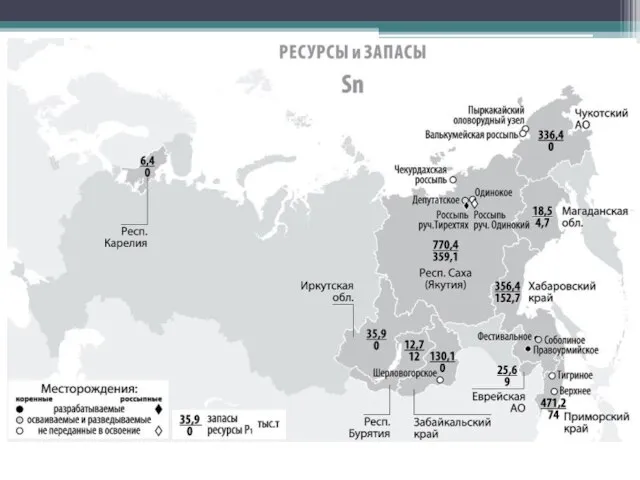
- 9. В России запасы оловянных руд расположены в Хабаровском крае в Чукотском автономном округе (месторождений закрыта в
- 12. Получение
- 13. Химические свойства (общие)
- 14. Химические свойства (общие)
- 15. Химические свойства олова (II)
- 16. Химические свойства олова (IV)
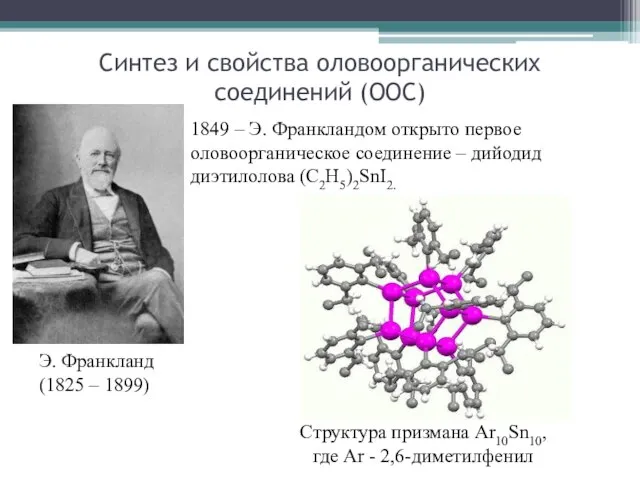
- 17. Синтез и свойства оловоорганических соединений (ООС) Э. Франкланд (1825 – 1899) 1849 – Э. Франкландом открыто
- 18. Синтез и свойства органических соединений олова (II) SnCl2 + 2EtLi → 2LiCl + Et2Sn Ph2SnH2 →
- 19. Синтез и свойства органических соединений олова (IV) Полнозамещенные соединения R4Sn, а также соединения типа R3SnX, R2SnX2
- 20. Алкилирование тетрахлорида олова реактивом Гриньяра в тетрагидрофуране: SnCl4 + 4RMgCl → R4Sn + MgCl2, где R
- 21. Синтез и свойства органических соединений олова (IV) Прямой синтез алкилгалогенидов олова: Окислительное присоединение:
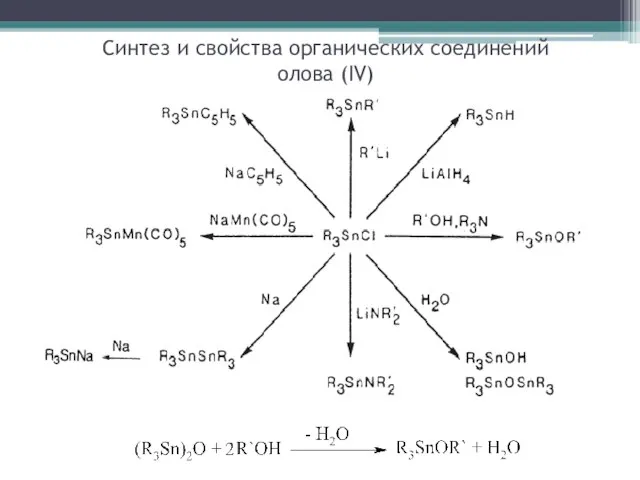
- 22. Синтез и свойства органических соединений олова (IV)
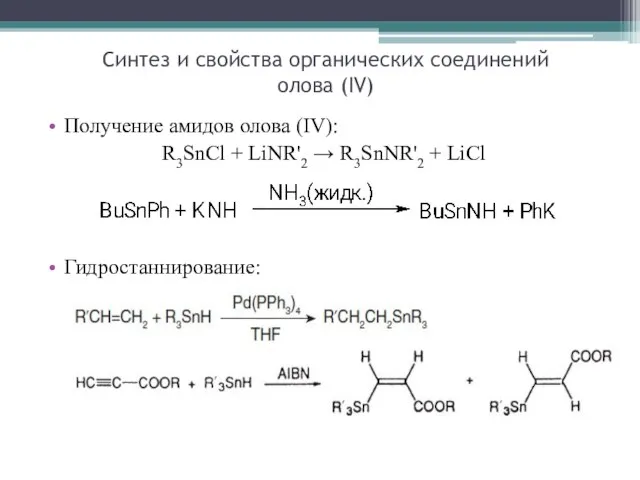
- 23. Получение амидов олова (IV): R3SnCl + LiNR'2 → R3SnNR'2 + LiCl Гидростаннирование: Синтез и свойства органических
- 24. ООС с двумя и тремя -OH группами нестойки: [R2Sn(OH)2] → [R2SnO] + H2O Связи Sn-R довольно
- 25. Применение Оловоорганические соединения ↗ → ↘ 60% - стабилизаторы поливинилхлорида 30% — биоциды 10% - различные
- 27. В начале 40-х годов была открыта способность некоторых ООС повышать устойчивость поливинилхлорида к нагреванию и действию
- 28. n-Bu2Sn(SCH2COO-i-C9H17)2) замедляет отщепление HCl в процессе термической обработки ПВХ при 180–200 °С путем замещения реакционноспособных аллильных
- 30. Применение Bu3SnOH широко применяется в текстильной и бумажной промышленности как антисептик, а также для защиты древесины
- 33. Скачать презентацию
















![ООС с двумя и тремя -OH группами нестойки: [R2Sn(OH)2] → [R2SnO] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/860556/slide-23.jpg)






 Вольфрам
Вольфрам Показатели обогащения
Показатели обогащения Химические формулы. Относительная молекулярная масса. 8 класс
Химические формулы. Относительная молекулярная масса. 8 класс Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"  Амины. Аминокислоты. Белки. (Лекция 8)
Амины. Аминокислоты. Белки. (Лекция 8) Природные источники углеводорода
Природные источники углеводорода Мыло. Интересно об известном
Мыло. Интересно об известном Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Жиры (липиды)
Жиры (липиды) Презентация Продукции Opet (3)
Презентация Продукции Opet (3) Химия и повседневная жизнь человека. Почистим изделия из металлов
Химия и повседневная жизнь человека. Почистим изделия из металлов Термохимия. Задания
Термохимия. Задания Гидролиз солей. Какие типы гидролиза возможны?
Гидролиз солей. Какие типы гидролиза возможны? Коррозия металлов
Коррозия металлов Игровые технологии на уроках химии как средство реализации системно-деятельного подхода в обучении
Игровые технологии на уроках химии как средство реализации системно-деятельного подхода в обучении Реакции ионного обмена
Реакции ионного обмена Презентация Лекция 1. Химическая термодинамика
Презентация Лекция 1. Химическая термодинамика Силикатная промышленность: Вчера, сегодня, завтра
Силикатная промышленность: Вчера, сегодня, завтра Согласованное и несогласованное действие заместителей в бензольном кольце
Согласованное и несогласованное действие заместителей в бензольном кольце Общие химические свойства металлов
Общие химические свойства металлов Супер-химия. Викторина
Супер-химия. Викторина Язык химии. Знаки химических элементов
Язык химии. Знаки химических элементов Алканы
Алканы Презентация на тему Алкины. Ацетилен
Презентация на тему Алкины. Ацетилен  Синтез ацетилена из природного газа в производстве ацетилена
Синтез ацетилена из природного газа в производстве ацетилена Сера
Сера Презентация на тему Алканы
Презентация на тему Алканы