Слайд 2Распространенность металлов в природе
Содержание некоторых металлов в земной коре:
Алюминий 8,2%
Железо 5,0%
Кальций 4,1%
Натрий

2,3%
Магний 2,3%
Калий 2,1%
Слайд 3Распространенность металлов в природе
Содержание некоторых металлов в морской воде:
Na+ 1,05%
Mg 2+ 0,12%

Слайд 4В природе металлы могут встречаться
Только в свободном (самородном) виде (благородные металлы -

золото, платина);
В самородном виде и в виде соединений (металлы малой активности – серебро, медь, ртуть, олово);
Только в виде соединений (металлы, стоящие в ряду напряжений до олова).
Слайд 11Чаще всего металлы встречаются в виде
Солей неорганических кислот
Оксидов

Слайд 12Сульфиды
Галенит PbS
Киноварь HgS
Пирит FeS2
И др.

Слайд 13Хлориды
Сильвин KCl
Галит NaCl
Сильвинит KCl • NaCl
Карналлит
KCl • MgCl2 • 6H2O
И

др.
Слайд 14Сульфаты, фосфаты, карбонаты
Барит BaSO4
Апатит Ca5(PO4)3(F,CI)
Мрамор CaCO3
Магнезит MgCO3
Малахит Cu2(OH)2CO3
И др.

Слайд 15Оксиды
Магнетит Fe3O4
Гематит Fe2O3
Каолин Al2O3 • 2SiO2 • 2H2O
И др.

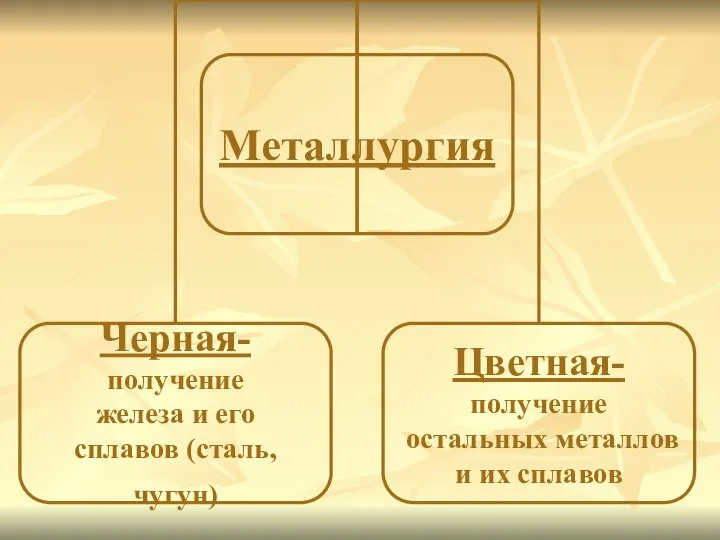
Слайд 16ЗАПИСАТЬ В ТЕТРАДЬ!
Минералы и горные породы, содержащие металлы и их соединения и

пригодные для промышленного получения металлов, называются рудами.
Отрасль промышленности, занимающаяся получением металлов из руд, называется металлургией.
Слайд 18
ЗАПИСАТЬ В ТЕТРАДЬ!
1. Пирометаллургия
Восстановление металлов из руд при высоких температурах с

помощью восстановителей.
Соль → оксид
Соли кислородсодержащих кислот – термическое разложение:
CuCO3 = CuO + CO2
Соли бескислородных кислот- обжиг:
2ZnS + ЗО2 = 2ZnО + 2SО2
Слайд 19ЗАПИСАТЬ В ТЕТРАДЬ!
Восстановление углем или угарным газом:
CuO + C → Cu +

CO
CuO + CO → Cu + CO2
Водородотермия:
Cr2O3 + H2 → Cr + H2O
Металлотермия:
Fe2O3 + Al → Fe + Al2O3
t
t
t
t
Слайд 20ЗАПИСАТЬ В ТЕТРАДЬ!
2. Гидрометаллургия
Получение металлов из растворов их солей.
Перевод нерастворимого соединения в

раствор:
CuO + H2SO4 = CuSO4 + H2O
Восстановление металла из раствора:
CuSO4 + Fe = FeSO4 + Cu.


















 Валентность химических элементов. Определение валентности элементов по формулам их соединений
Валентность химических элементов. Определение валентности элементов по формулам их соединений Башня плотности
Башня плотности Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации Пакет заданий №2. Команда вечерний дозор
Пакет заданий №2. Команда вечерний дозор Кислород
Кислород Сплавы металлов
Сплавы металлов Химические реакции
Химические реакции Агрегатные состояния вещества
Агрегатные состояния вещества Общие вопросы материаловедения
Общие вопросы материаловедения Углеводороды
Углеводороды Природный газ
Природный газ Роль органической химии в производстве и повседневной жизни человека
Роль органической химии в производстве и повседневной жизни человека Спирты в жизни человека
Спирты в жизни человека Создание памятки на тему Пищевые добавки
Создание памятки на тему Пищевые добавки Elektroliz_Gidroliz
Elektroliz_Gidroliz Предельные одноатомные спирты
Предельные одноатомные спирты Галогены. 9 класс
Галогены. 9 класс Презентация на тему Жизнь и деятельность Д.И. Менделеева
Презентация на тему Жизнь и деятельность Д.И. Менделеева  Металлы. Тестирование
Металлы. Тестирование Соли как производные кислот и оснований
Соли как производные кислот и оснований Презентация на тему Расчеты по химическим уравнениям
Презентация на тему Расчеты по химическим уравнениям  Silīcija savienojumi
Silīcija savienojumi Химическая связь. Урок-упражнение
Химическая связь. Урок-упражнение Серная кислота и ее соли
Серная кислота и ее соли Дифференциальный термический анализ
Дифференциальный термический анализ Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Презентация по Химии "Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»"
Презентация по Химии "Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»"  Презентация на тему Основания и их классификация
Презентация на тему Основания и их классификация