Содержание
- 2. Лекция 4 Кулонометрия. Кулонометрическое титрование
- 3. Кулонометрия. Кулонометрическое титрование Кулонометрия - электрохимический метод анализа, основанный на измерении количества электричества Q, необходимого для
- 4. Разновидности Кулонометрии В зависимости от происходящих электродных процессов кулонометрические методы подразделяют на: прямую кулонометрию косвенную кулонометрию
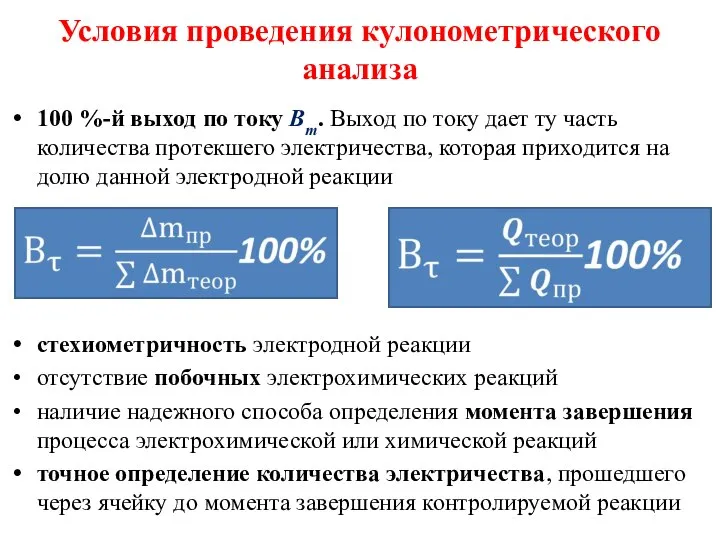
- 5. Условия проведения кулонометрического анализа 100 %-й выход по току Вт. Выход по току дает ту часть
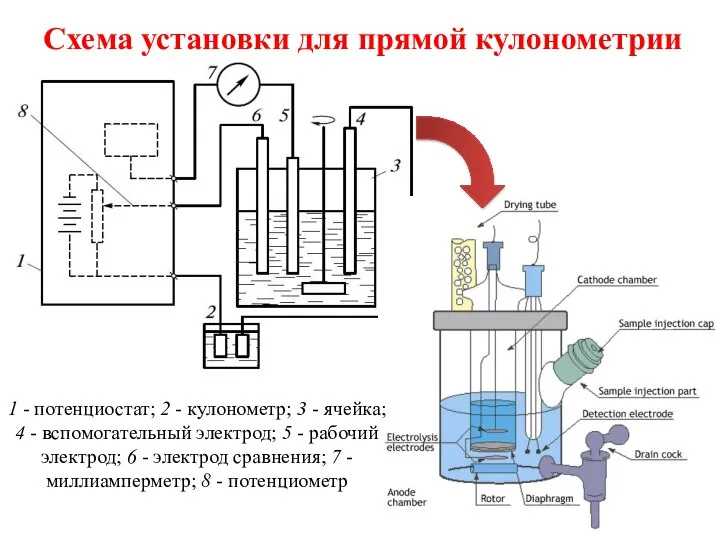
- 6. Схема установки для прямой кулонометрии 1 - потенциостат; 2 - кулонометр; 3 - ячейка; 4 -
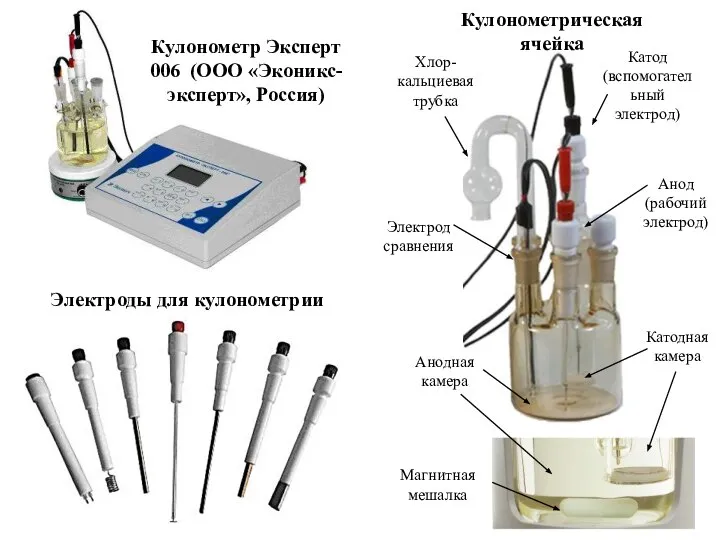
- 7. Кулонометр Эксперт 006 (ООО «Эконикс-эксперт», Россия) Кулонометрическая ячейка Магнитная мешалка Электроды для кулонометрии
- 8. Прямая потенциостатическая кулонометрия E = const Выбор потенциала рабочего электрода проводят на основании кривых «сила тока-потенциал»
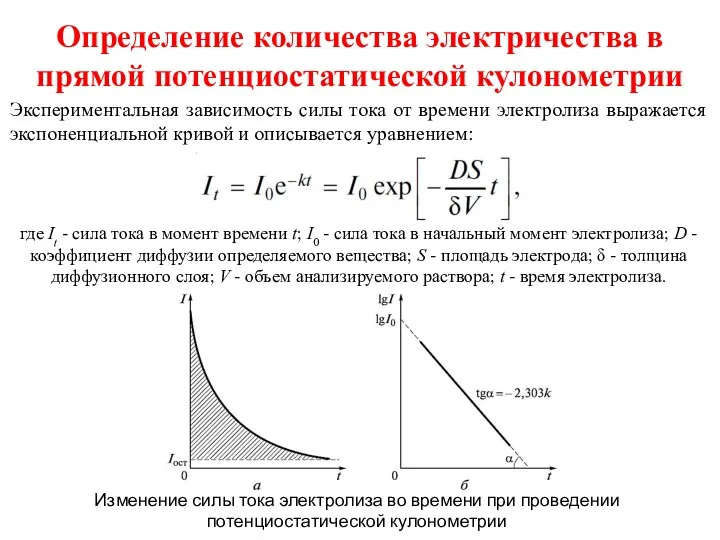
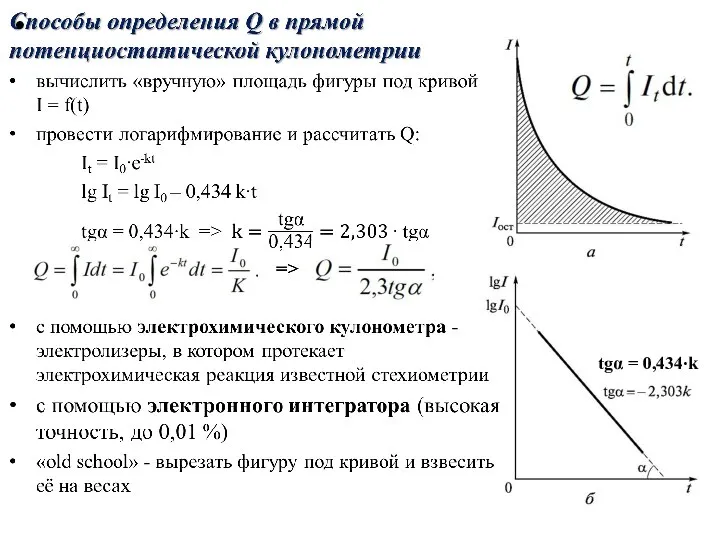
- 9. Определение количества электричества в прямой потенциостатической кулонометрии Экспериментальная зависимость силы тока от времени электролиза выражается экспоненциальной
- 10. tgα = 0,434∙k
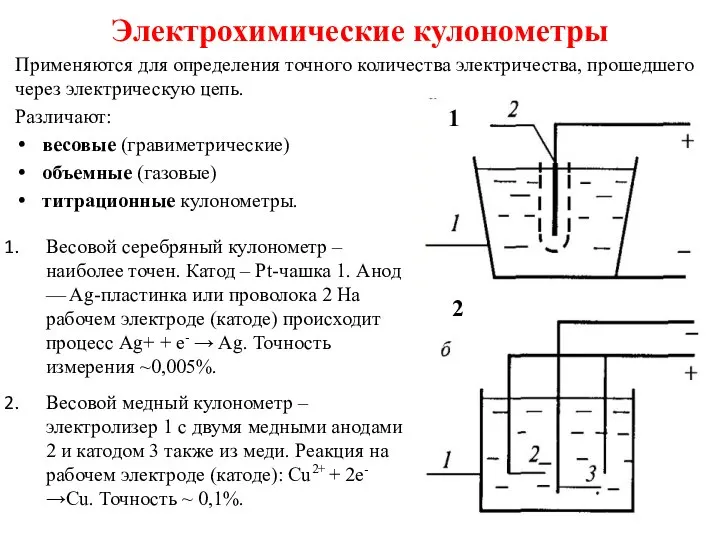
- 11. Электрохимические кулонометры Применяются для определения точного количества электричества, прошедшего через электрическую цепь. Различают: весовые (гравиметрические) объемные
- 12. Преимущества и области применения прямой потенциостатической кулонометрии Безэталонный (абсолютный) метод! Используется для определения растворенных веществ. Нижняя
- 13. Кулонометрическое титрование КТ - основано на взаимодействии определяемого вещества с титрантом, который получают электролизом; титрант в
- 14. Примеры генераторных реакций титранта в кулонометрическом титровании
- 15. Требования осуществления Кулонометрического титрования 100%-й выход по току при электрогенерации титранта быстрое колич. протекание химической реакции
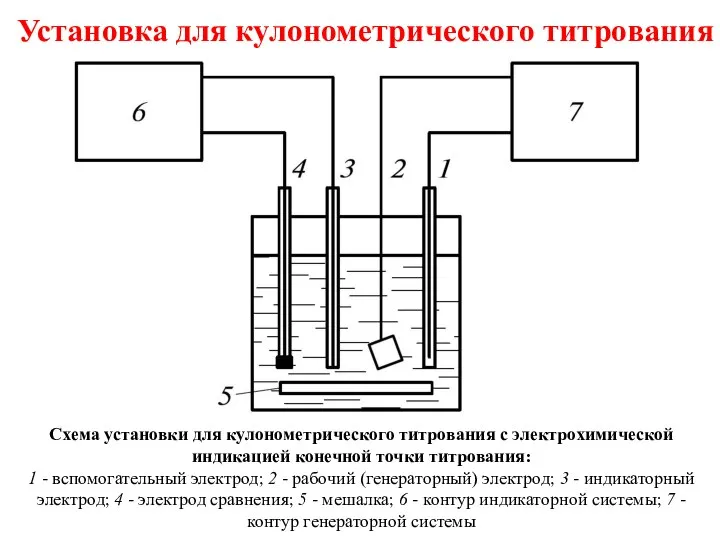
- 16. Установка для кулонометрического титрования Схема установки для кулонометрического титрования с электрохимической индикацией конечной точки титрования: 1
- 17. Способы индикации конечной точки тирования Визуальные индикаторные методы (крахмал, метиловый оранжевый, фенолфталеин и т.д.) Потенциометрический (Pt
- 18. Преимущества кулонометрического титрования Можно опр. очень малые количества в-в с большой точностью. Можно использ. нестойкие титранты
- 19. Примеры аналитического применения кулонометрического титрования
- 20. Кулонометрическое титрование воды по Фишеру (Карл Фишер, 1935 г.) Реактив Фишера: Спирт – ROH (метанол или
- 22. Скачать презентацию












 Биологическое окисление
Биологическое окисление Основные диагностические признаки сапфира и его имитаций
Основные диагностические признаки сапфира и его имитаций Проект по химии. Минералы на нашей коже
Проект по химии. Минералы на нашей коже Химия и ее значение
Химия и ее значение Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Основания
Основания Презентация на тему Углерод
Презентация на тему Углерод  Цинк и его применение (11 класс)
Цинк и его применение (11 класс) Презентация на тему Химия моя профессия
Презентация на тему Химия моя профессия  Водород, его общая характеристика, нахождение в природе и его свойства
Водород, его общая характеристика, нахождение в природе и его свойства Закономерности протеканий химических реакций
Закономерности протеканий химических реакций Вода
Вода Дистилляция (перегонка). 7 класс
Дистилляция (перегонка). 7 класс Инфракрасное электромагнитное излучение
Инфракрасное электромагнитное излучение Классы неорганических соединений
Классы неорганических соединений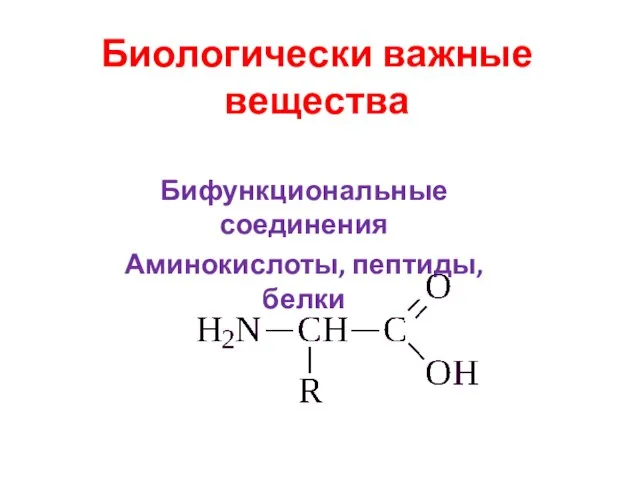 Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Алюминий
Алюминий Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Тест по теме Альдегиды и кетоны
Тест по теме Альдегиды и кетоны Презентация на тему Путешествие в мир химии
Презентация на тему Путешествие в мир химии  Проектная деятельность учащихся по химии
Проектная деятельность учащихся по химии Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Очистка рабочих электродов
Очистка рабочих электродов Изменение химмотологических свойств цетанповышающей присадки в процессе хранения
Изменение химмотологических свойств цетанповышающей присадки в процессе хранения Металлы тоже воевали… 8 класс
Металлы тоже воевали… 8 класс Получение и свойства полиэтилена
Получение и свойства полиэтилена Оценка качества пищевой соли, реализуемой в розничной торговле
Оценка качества пищевой соли, реализуемой в розничной торговле Термореактивные пластмассы (реактопласты)
Термореактивные пластмассы (реактопласты)