Содержание
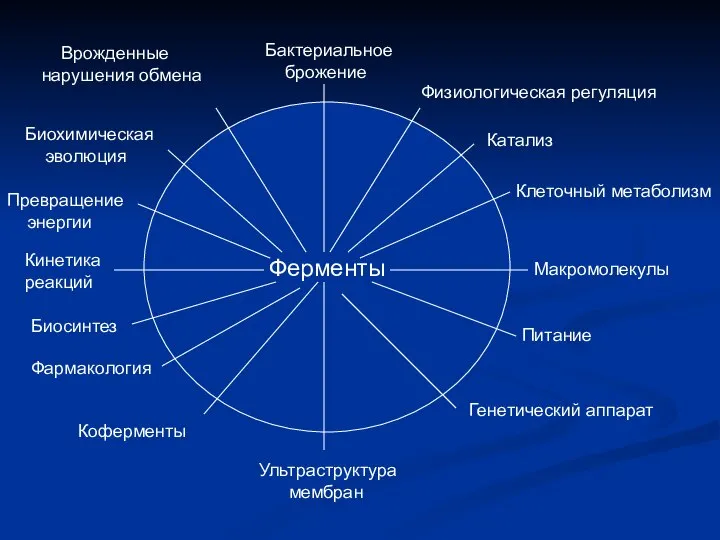
- 2. Ферменты Бактериальное брожение Физиологическая регуляция Катализ Клеточный метаболизм Макромолекулы Питание Генетический аппарат Ультраструктура мембран Коферменты Фармакология
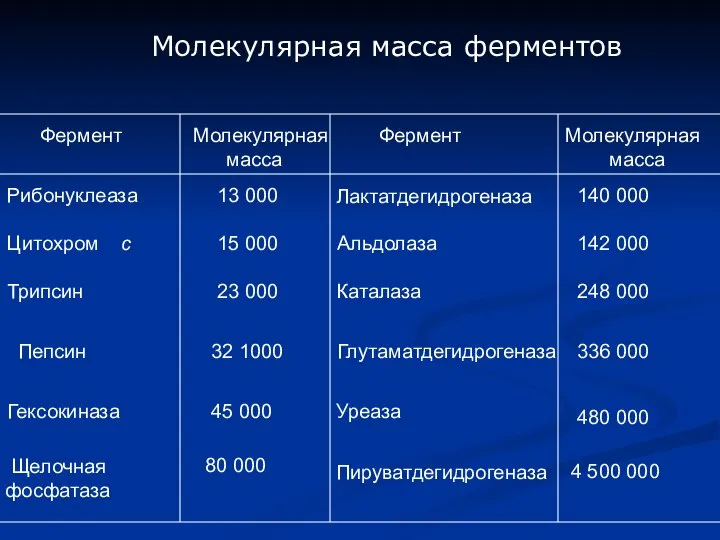
- 3. Фермент Молекулярная масса Фермент Молекулярная масса Рибонуклеаза 13 000 Лактатдегидрогеназа 140 000 Цитохром с 15 000
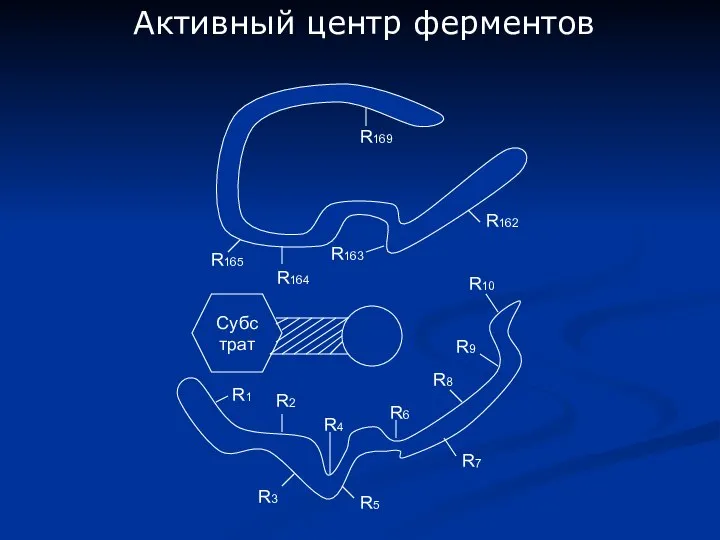
- 4. Активный центр ферментов Субстрат R1 R2 R3 R5 R4 R6 R7 R8 R9 R10 R165 R164
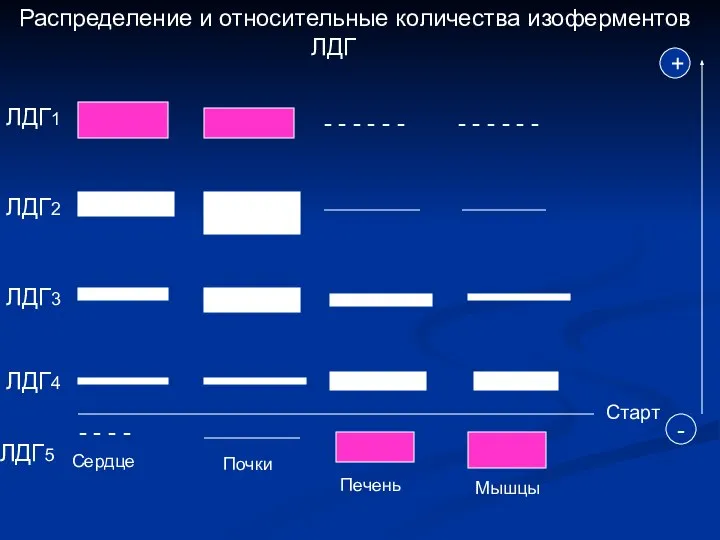
- 5. Распределение и относительные количества изоферментов ЛДГ ЛДГ1 - - - - - - - - -
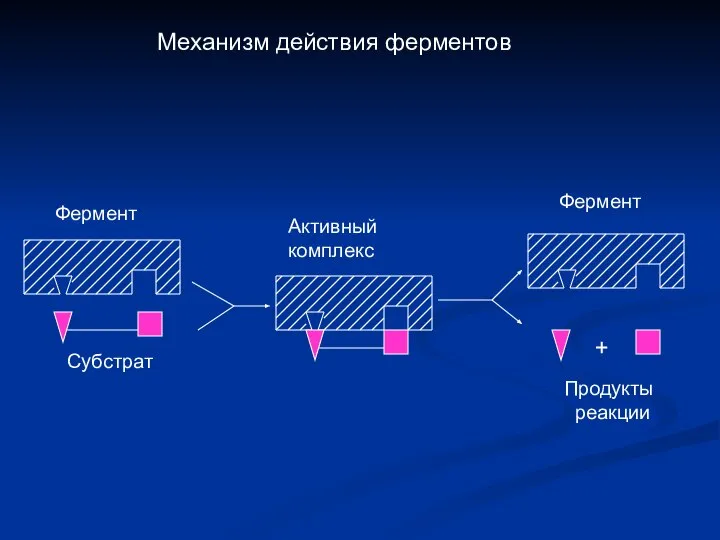
- 6. Механизм действия ферментов Субстрат + Фермент Активный комплекс Продукты реакции Фермент
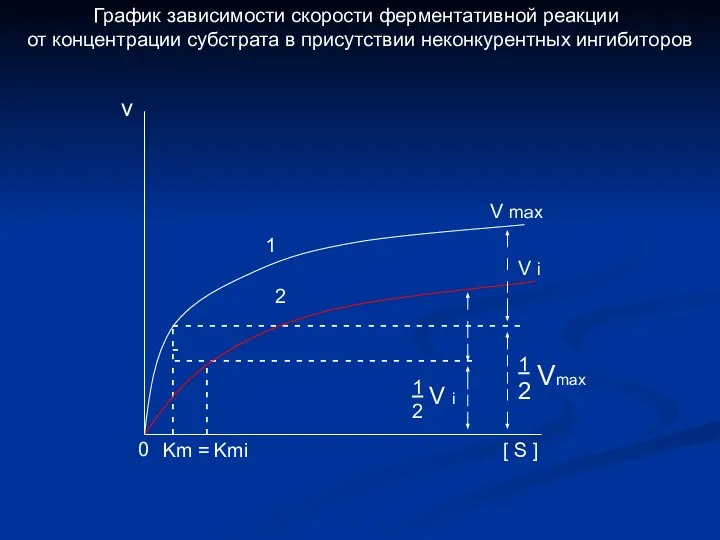
- 7. - - - - - - - - - - - - - - - -
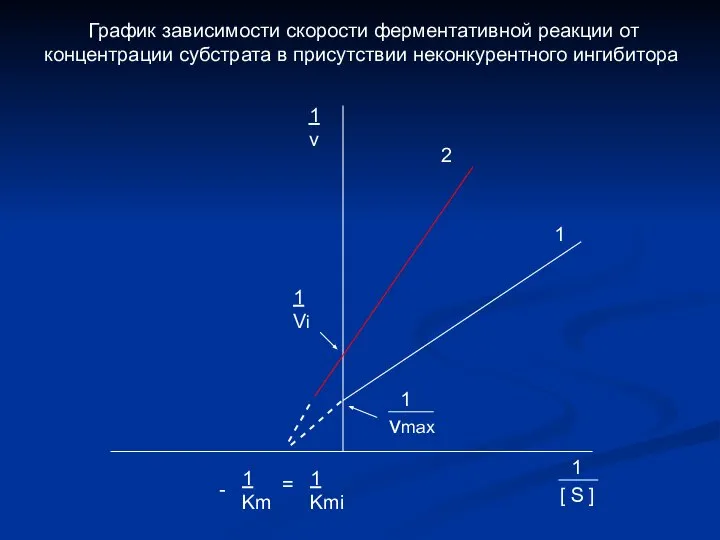
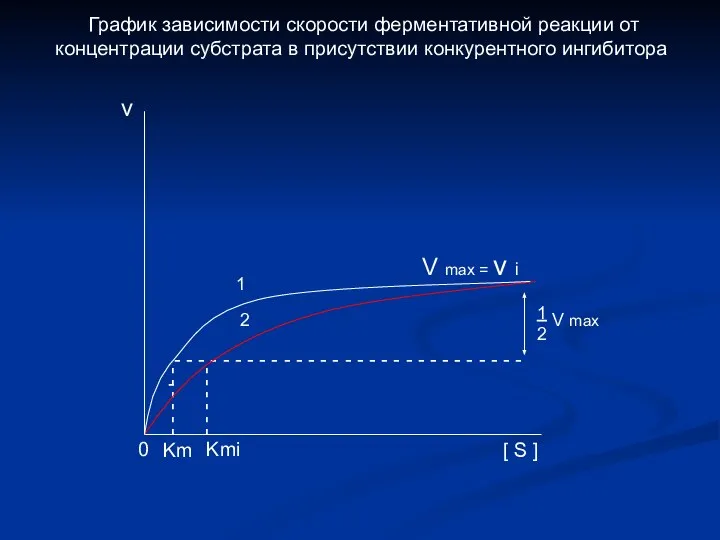
- 8. - - - - - - - - - - 1 Km 1 Kmi = 1
- 9. - - - - - - - - - - - - - - - -
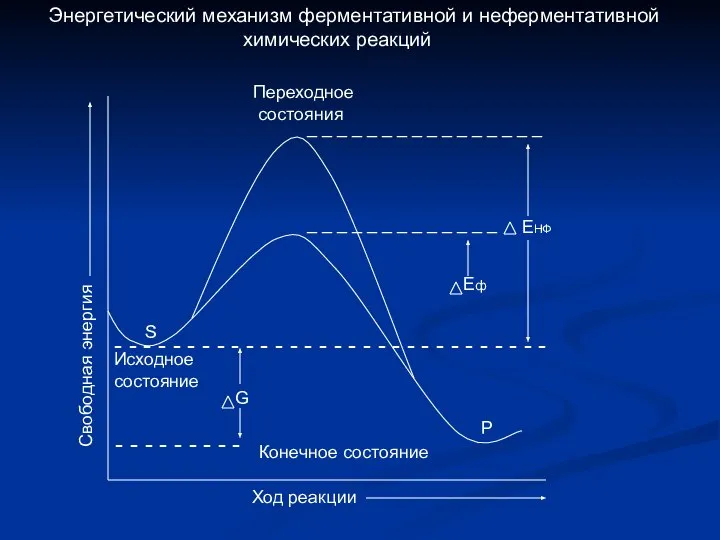
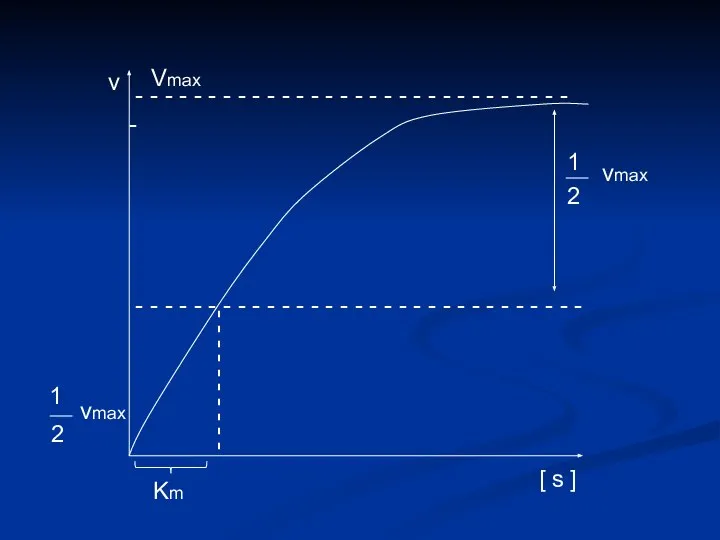
- 10. Уравнение Михаэлиса - Ментен VMAX . . [ s ] Кs + [ s ] v
- 11. - - - - - - - - - - - - - - - -
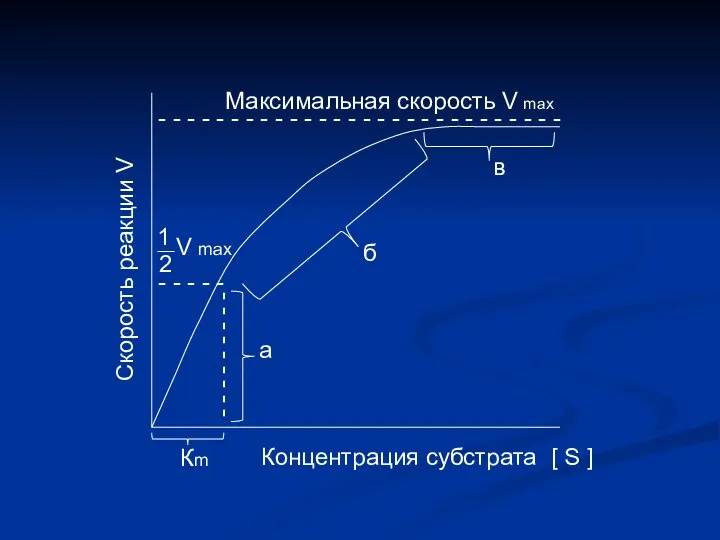
- 12. Определение численного значения Кm Если v = ½ vmax V max 2 = V max .
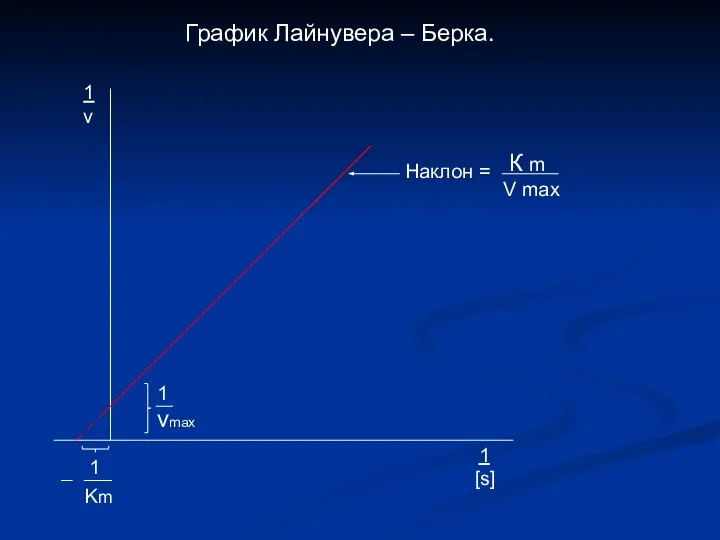
- 13. График Лайнувера – Берка. 1 vmax 1 Km Наклон = К m V max 1 v
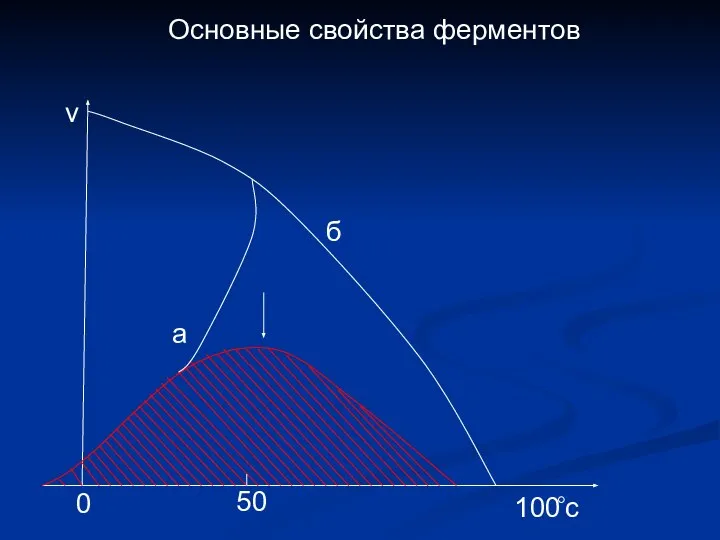
- 14. Основные свойства ферментов а б v 100 0 c 50
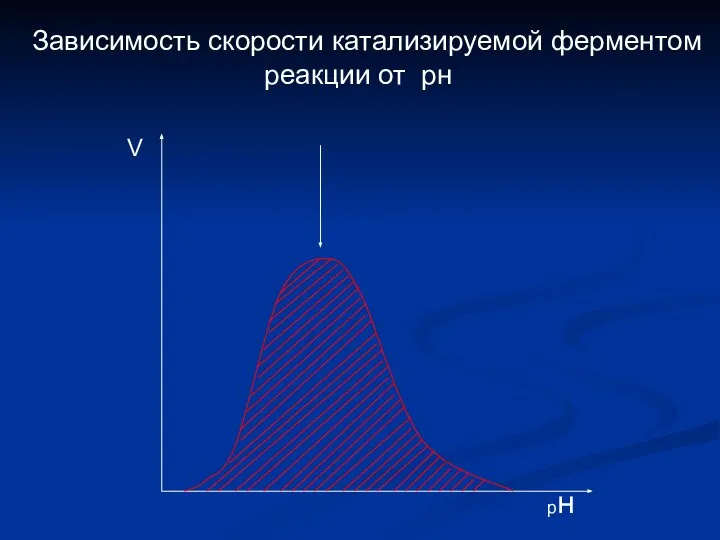
- 15. Зависимость скорости катализируемой ферментом реакции от рн рн V
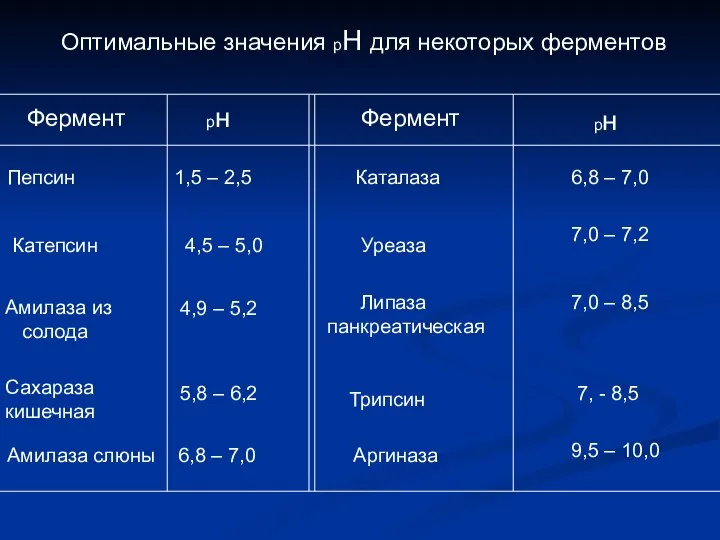
- 16. Оптимальные значения рН для некоторых ферментов Фермент рн Фермент рн Пепсин 1,5 – 2,5 Каталаза 6,8
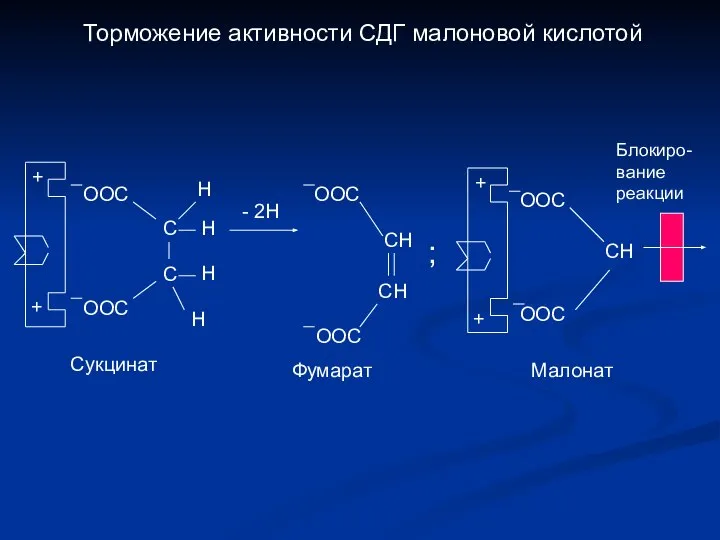
- 17. Торможение активности СДГ малоновой кислотой + + ООС ООС С С Н Н Н Н -
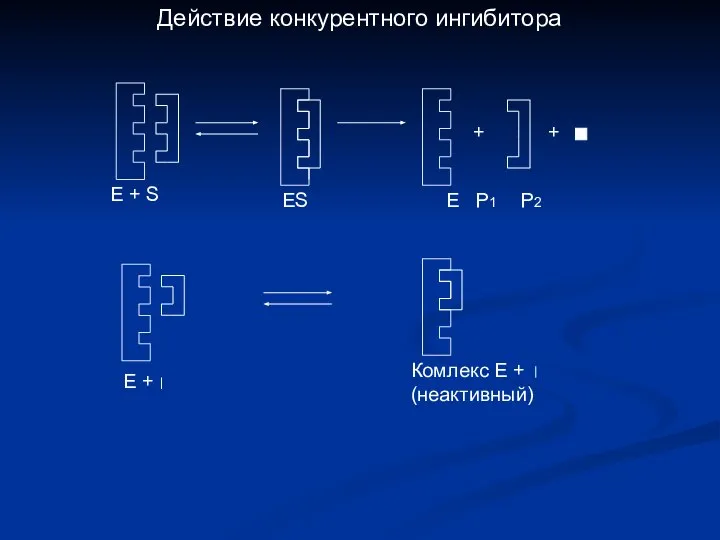
- 18. + + Е + Комлекс Е + (неактивный) Е + S ES E P1 P2 Действие
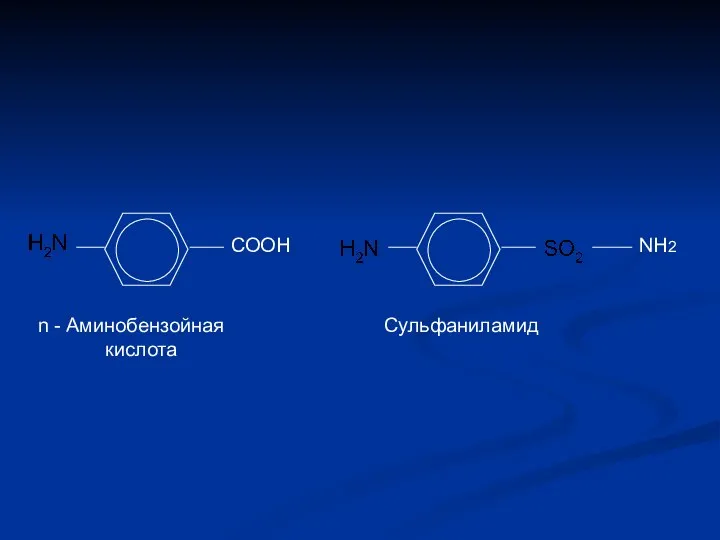
- 19. СООН NH2 n - Аминобензойная кислота Сульфаниламид
- 20. - - - - - - - - - - - - - - - -
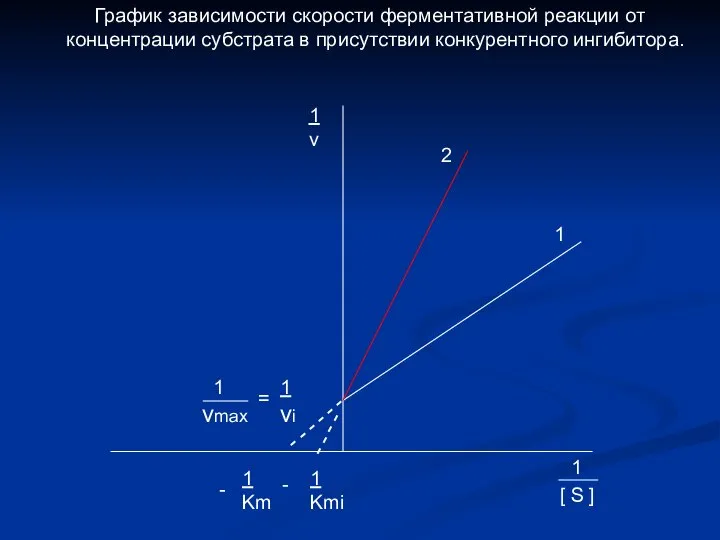
- 21. - - - - - - - - - - 1 vmax = 1 vi 1
- 22. - - - - - - - - - - - - - - - -
- 24. Скачать презентацию
![Уравнение Михаэлиса - Ментен VMAX . . [ s ] Кs +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1027287/slide-9.jpg)

 Кислота
Кислота Алюминий
Алюминий Скорость химической реакции. Факторы, влияющие на скорость
Скорость химической реакции. Факторы, влияющие на скорость Металлы. Группы металлов
Металлы. Группы металлов Синтетические душистые вещества
Синтетические душистые вещества 3 Серная кислота
3 Серная кислота Химические реакции
Химические реакции Комплексонометрическое титрование. Часть 2. Лекция 6
Комплексонометрическое титрование. Часть 2. Лекция 6 Алкины
Алкины Основные сведения о металлах и сплавах и их свойства
Основные сведения о металлах и сплавах и их свойства Алкины
Алкины Михаил Васильевич Ломоносов (1711-1765)
Михаил Васильевич Ломоносов (1711-1765) Получение меди
Получение меди Рівноваги у розчинах електролітів
Рівноваги у розчинах електролітів Типы химических реакций
Типы химических реакций Производство чугуна и стали
Производство чугуна и стали Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры
Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1
Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1 Уравнение материального баланса технологического процесса. (Лекция 3)
Уравнение материального баланса технологического процесса. (Лекция 3) Презентация на тему Таблица Менделеева и строение атома
Презентация на тему Таблица Менделеева и строение атома  Обобщение знаний об углеводородах
Обобщение знаний об углеводородах Микроструктура железоуглеродистых сплавов в равновесном состоянии
Микроструктура железоуглеродистых сплавов в равновесном состоянии Викторина: А не химик ли ты?
Викторина: А не химик ли ты? Гетерофункциональные органические соединения
Гетерофункциональные органические соединения Классификация углеводородов
Классификация углеводородов Химический элемент титан
Химический элемент титан Аминокислоты. Белки. Лекция 2
Аминокислоты. Белки. Лекция 2 Алкины. Способы получения
Алкины. Способы получения