Содержание
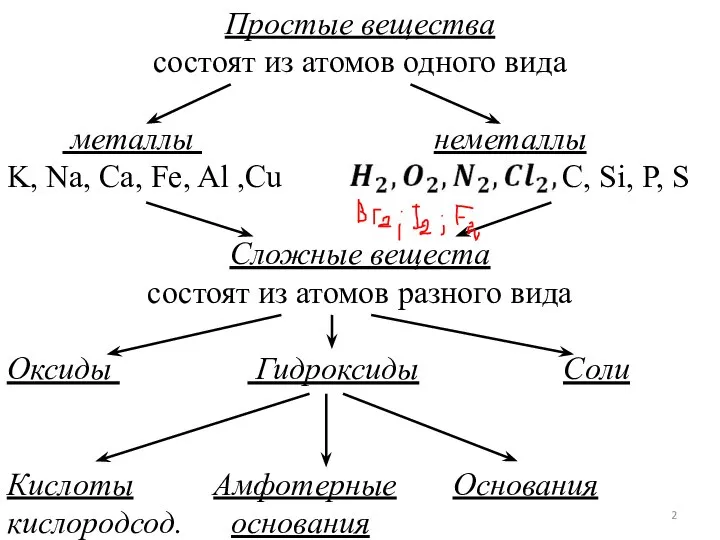
- 2. Простые вещества состоят из атомов одного вида металлы неметаллы K, Na, Ca, Fe, Al ,Cu C,
- 3. ОКСИДЫ - это сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления
- 4. кислотные - ,CrO3, амфотерные – BeO, - основные - MnO Существуют двойные (смешанные) оксиды – содержащие
- 5. Кислотные оксиды оксиды, которым соответствуют кислоты, большинство из которых могут быть получены при взаимодействии этих оксидов
- 6. Некоторые оксиды, в которых атомы неметалла находятся в неустойчивой, нехарактерной им промежуточной степени окисления, при взаимодействии
- 7. Амфотерные оксиды - оксиды, которым соответствуют амфотерные основания. Амфотерность – двойственность. Амфотерные оксиды в зависимости от
- 8. Основные оксиды оксиды, которым соответствуют основания. При взаимодействии оксидов щелочных и щелочноземельных металлов (Li, Na, K,
- 9. Кислоты - это сложные вещества, состоящие из атомов водорода, которые способны замещаться на атомы металла, и
- 10. - серная - - сульфат - ортофосфорная - - фосфат - азотистая - - нитрит -
- 11. Основания - это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп. ОНˉ -
- 12. Амфотерные гидроксиды это сложные вещества, имеющие свойства как кислот, так и оснований. Формулы амфотерных гидроксидов можно
- 13. - метаалюминиевая кислота - метаалюминат натрия - ортохромистая кислота - метахромистая кислота - хромит натрия -
- 14. Соли - это сложные вещества, состоящие из атомов металла (ионов аммония) и кислотного остатка. Средние соли
- 15. Кислые соли это продукты неполного замещения водорода в многоосновной кислоте на атомы металла. - гидрокарбонат натрия
- 17. Скачать презентацию













 897386 (2)
897386 (2) Кристаллизация и десублимация
Кристаллизация и десублимация Химическое равновесие
Химическое равновесие Разбор заданий на амины
Разбор заданий на амины Цезій
Цезій Количество вещества. Моль
Количество вещества. Моль Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері
Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері Презентация на тему Задачи на смеси и сплавы (9 класс)
Презентация на тему Задачи на смеси и сплавы (9 класс)  Основные диагностические признаки рубина и его имитаций
Основные диагностические признаки рубина и его имитаций Потенциометрические анализаторы Поверка рН - метра
Потенциометрические анализаторы Поверка рН - метра Катализ в нефтепереработке
Катализ в нефтепереработке proekt_TTU_3_1
proekt_TTU_3_1 Задачи на ионные равновесия
Задачи на ионные равновесия Углеводороды (УВ)
Углеводороды (УВ) Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Строение атома. Строение электронных оболочек атомов
Строение атома. Строение электронных оболочек атомов Аммиак
Аммиак Обмен нуклеопротеинов в организме
Обмен нуклеопротеинов в организме Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии
Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии Номенклатура алканов разветвленного строения
Номенклатура алканов разветвленного строения Водородная химическая связь
Водородная химическая связь ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ
ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ Аллотропия
Аллотропия Кристаллы и аморфные тела
Кристаллы и аморфные тела Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды
Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды Арены. Бензол
Арены. Бензол Презентация на тему Поверхностно-активные вещества
Презентация на тему Поверхностно-активные вещества  Ферментативные методы анализа
Ферментативные методы анализа