Содержание
- 4. реакция вытеснения одного металла другим сопровождается переносом электронов. Реакция представляет собой комбинацию двух полуреакций — окисления
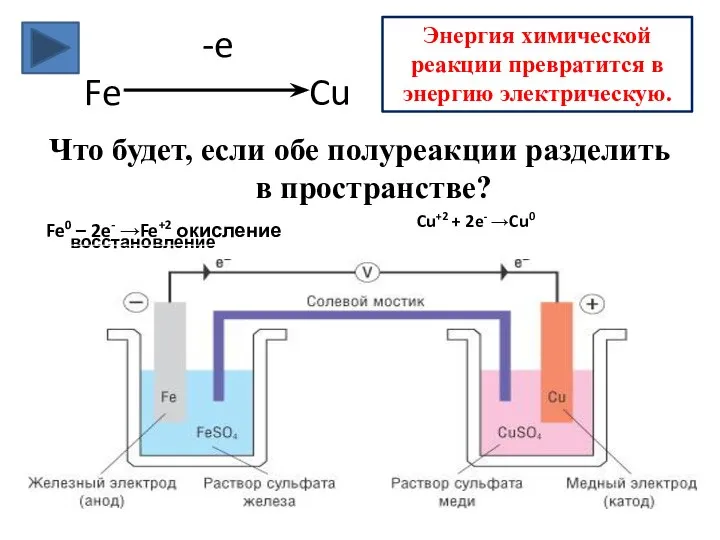
- 5. -e Fe Cu Что будет, если обе полуреакции разделить в пространстве? Cu+2 + 2e- →Cu0 восстановление
- 6. Гальванический элемент — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в
- 8. Слева направо восстановительная активность металлов уменьшается Слева направо окислительная активность металлов увеличивается Каждый металл способен вытеснять
- 9. Проверим себя: Укажите уравнения реакций, которые можно использовать в химических источниках тока: NaOH + HCl =
- 10. Назовите два металла, которые можно использовать для вытеснения железа из раствора сульфата железа (II) Напишите уравнения
- 12. Скачать презентацию








 Вода. Физические и химические свойства
Вода. Физические и химические свойства Кислоты. Классификация кислот
Кислоты. Классификация кислот Экстракция молибдат-ионов в расслаивающейся системе антипирин – сульфосалициловая кислота – вода
Экстракция молибдат-ионов в расслаивающейся системе антипирин – сульфосалициловая кислота – вода Презентация по Химии "Законы газового состояния вещества"
Презентация по Химии "Законы газового состояния вещества"  Углеводы. Общие представления об углеводах
Углеводы. Общие представления об углеводах Презентация на тему Соли аммония
Презентация на тему Соли аммония  Химические уравнения. 8 класс
Химические уравнения. 8 класс Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9
Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9 Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Каучук
Каучук Многоатомные спирты
Многоатомные спирты Презентация на тему Роль химии в жизни человека
Презентация на тему Роль химии в жизни человека  Які існують способи розділення сумішей?
Які існують способи розділення сумішей? Медь и её сплавы
Медь и её сплавы Карбоксилденген этоксилаттар
Карбоксилденген этоксилаттар Bool-doser team
Bool-doser team Инфракрасное электромагнитное излучение
Инфракрасное электромагнитное излучение Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Гравиметрический анализ. Лекция 1
Гравиметрический анализ. Лекция 1 Фторсодержащие полимеры
Фторсодержащие полимеры Dense Yttria Film Deposited on a Plasma-Sprayed Al2Oз Coating by Aerosol Deposition
Dense Yttria Film Deposited on a Plasma-Sprayed Al2Oз Coating by Aerosol Deposition Химические равновесия в растворах. Лекция 2 часть 2
Химические равновесия в растворах. Лекция 2 часть 2 Общая характеристика VIIА-группы – Галогены
Общая характеристика VIIА-группы – Галогены Классификация оганических соединений. 10 класс
Классификация оганических соединений. 10 класс Азот. Аммиак. Соли аммония (1)
Азот. Аммиак. Соли аммония (1) Углеводы
Углеводы Превращения в нашей жизни: физические и химические
Превращения в нашей жизни: физические и химические Производство азотных удобрений
Производство азотных удобрений