Слайд 2Факторы, влияющие на растворимость осадков
1. Концентрация ионов водорода
Растворимость осадков, образованных анионами слабых

кислот, увеличивается с увеличением концентрации ионов водорода.
CaF2 = Ca2+ + 2F-
↓+2H+
2HF
Равновесие сдвигается в сторону растворения осадка.
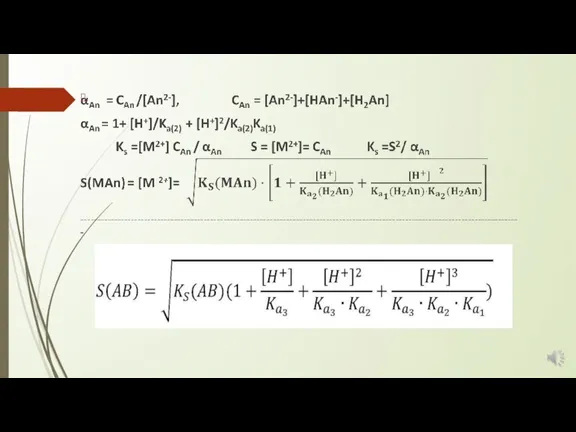
Слайд 3 MAn (ос) ⇄ M2+ + An2−
Ks(MAn) = [M2+][An2- ]
![MAn (ос) ⇄ M2+ + An2− Ks(MAn) = [M2+][An2- ] При добавлении](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1148899/slide-2.jpg)
При добавлении сильной кислоты в раствор над осадком An2− связываются с ионами H+ , образуя слабую двухосновную кислоту H2An:
An2− + H+ ⇄ HAn − Ka(2) = [An2-][H+] /[HAn-]
HAn − + H+ ⇄ H2An Ka(1) = [HAn-][H+] /[H2An];
[HAn-]= [An2-][H+]/Ka(2)
[H2An]=[HAn-][H+]/Ka(1) = [An2-][H+]2/Ka(1)Ka(2)
Степень взаимодействия An2− с H+ характеризуется коэффициентом побочной реакции αA
Слайд 8αA = [A]+[AL]+[AL2]+…+[ALn] /[A]
ẞ1 = [AL]/[A][L]; [AL]= ẞ1[A][L]
ẞ2 =[AL2]/[A][L]2
![αA = [A]+[AL]+[AL2]+…+[ALn] /[A] ẞ1 = [AL]/[A][L]; [AL]= ẞ1[A][L] ẞ2 =[AL2]/[A][L]2 [AL2]=](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1148899/slide-7.jpg)
[AL2]= ẞ2[A][L]2
---------------------------------------------------------------
ẞn=[ALn]/[A][L]n [ALn]= ẞn[A][L]n
αA= 1+ ẞ1[L] + ẞ2[L]2 + … + ẞn[L]n
Слайд 13Например: При добавлении к раствору над осадком AgCl раствора KCl до концентрации

10-3 моль / л растворимость AgCl уменьшается. При увеличении концентрации KCl – увеличивается за счет образования растворимых хлоридных комплексов серебра. Поэтому при количественном определении серебра для полного осаждения берут 1,5- кратный избыток осадителя, не больше.
Слайд 15 Протолитические равновесия
Теория Бренстеда-Лаури
Кислоты – вещества, способные отщеплять ионы водорода.
Основания – вещества,

способные принимать ионы водорода.
Обе группы веществ получили название протолиты, а их взаимодействие протолитическим.
Кислоты: HCl, H2SO4 , NH4+, HCO3-
Основания: NaOH, NH3 , HCO3-
Слайд 16 Вещества, способные при определенных условиях отдавать или
принимать ионы водорода, называются амфипротонными

или
амфолитами (HCO3-)
HAn = H+ + An- B + H+ = BH+
к-та сопряженное основаниe сопряженная
основание кислота
HAn / An- ; B/ BH+ - сопряженные протолитические пары
H2O + H2O = H3O+ + OH- - Реакция авторотолиза Kw = 10-14
к-та осн. сопр.к-та сопр.осн.

![MAn (ос) ⇄ M2+ + An2− Ks(MAn) = [M2+][An2- ] При добавлении](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1148899/slide-2.jpg)



![αA = [A]+[AL]+[AL2]+…+[ALn] /[A] ẞ1 = [AL]/[A][L]; [AL]= ẞ1[A][L] ẞ2 =[AL2]/[A][L]2 [AL2]=](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1148899/slide-7.jpg)








 Химическая кинетика
Химическая кинетика Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде Кислотно-основное равновесие
Кислотно-основное равновесие Тест по теме Основные классы неорганических соединений
Тест по теме Основные классы неорганических соединений Физическая химия поверхностных явлений
Физическая химия поверхностных явлений Электролитическая диссоциация кислот
Электролитическая диссоциация кислот 11 класс 15.09
11 класс 15.09 Степень окисления серы
Степень окисления серы Виды работ на уроках химии
Виды работ на уроках химии Презентация на тему Металлическая связь
Презентация на тему Металлическая связь  Действие активированного угля
Действие активированного угля Презентация на тему Твердые вещества
Презентация на тему Твердые вещества  Органическая химия
Органическая химия Природные смолы: мирра, ладан и шеллак
Природные смолы: мирра, ладан и шеллак Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов
Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов Валентность
Валентность Карбоновые кислоты
Карбоновые кислоты Обобщение знаний по курсу органической химии
Обобщение знаний по курсу органической химии Кислород и сера. Их положение в ПСХЭ. Значение и применение
Кислород и сера. Их положение в ПСХЭ. Значение и применение 20140111_mineraly
20140111_mineraly Кислоты
Кислоты Арены. Ароматические углеводороды
Арены. Ароматические углеводороды Презентация на тему Химические свойства многоатомных спиртов
Презентация на тему Химические свойства многоатомных спиртов  Генетичні зв’язки між неорганічними речовинами
Генетичні зв’язки між неорганічними речовинами Многообразие веществ
Многообразие веществ Калийные удобрения. Лекция 28
Калийные удобрения. Лекция 28 Простагландины. Воздействие фосфолипаз на фосфолипид
Простагландины. Воздействие фосфолипаз на фосфолипид Химия углеводов
Химия углеводов