Содержание
- 2. Нахождение в природе
- 3. ОБЩАЯ ХАРАКТЕРИСТИКА ГАЛОГЕНОВ Галогены – это естественная группа элементов , расположенных в главной подгруппе VII группы.
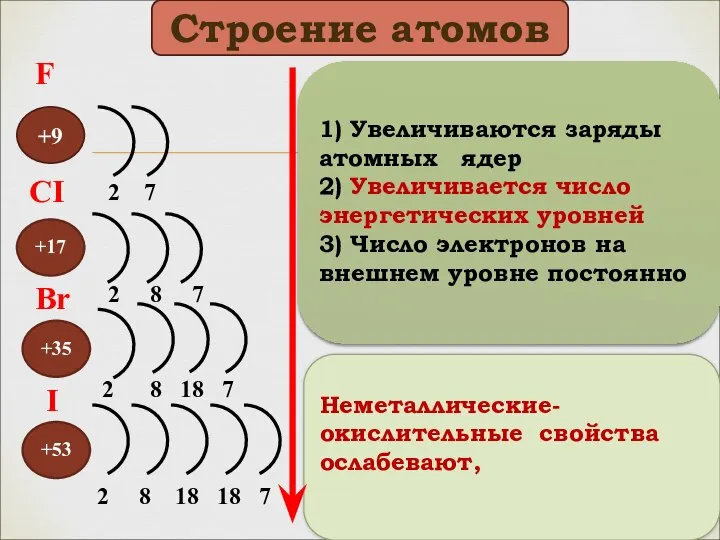
- 4. +9 +53 +35 +17 Неметаллические-окислительные свойства ослабевают, 2 7 2 8 7 2 8 18 7
- 5. CI2 Br2 I2 F2 Простые вещества
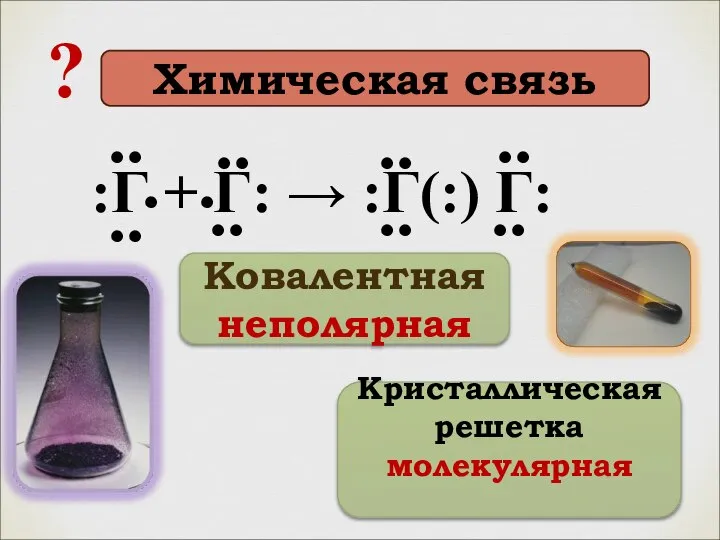
- 6. :Г + Г: → :Г(:) Г: .. .. .. .. .. .. .. .. . .
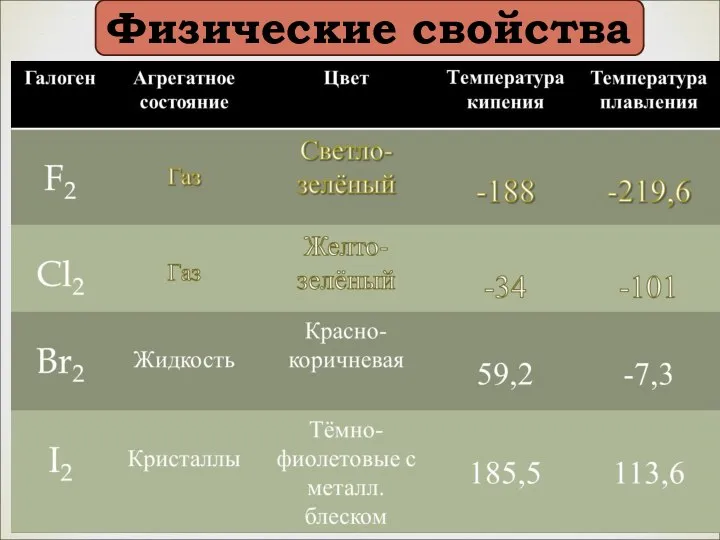
- 7. Физические свойства
- 8. 1.Взаимодействие с металлами= соль Химические свойства 2Fe0 + 3Br20= 2Fe3+Br3- + - Br20 окислитель
- 9. 2.Взаимодействие с водородом = летучие водородные соединения Н20 + Г20 = 2Н+ Г- Н20 + CI20
- 10. 3.Взаимодействие с водой 2F2 + 2Н2 О = 4НF + О2 Плавиковая кислота
- 11. 4.Взаимодействие с растворами солей галогенов: CI2 F2 Br2 I2 CI2 + 2NaBr = 2 NaCl +
- 13. Скачать презентацию







 Электроотрицательность химических элементов
Электроотрицательность химических элементов Производство азотных удобрений
Производство азотных удобрений Презентация на тему Подготовка к ГИА по химии
Презентация на тему Подготовка к ГИА по химии  Презентация на тему Полисахариды. Крахмал и целюлоза
Презентация на тему Полисахариды. Крахмал и целюлоза  Алканы. Бутан - С4Н10
Алканы. Бутан - С4Н10 Химическая термодинамика
Химическая термодинамика Пептиды, белки. Лабораторное занятие
Пептиды, белки. Лабораторное занятие Аммиак. Состав вещества
Аммиак. Состав вещества Silīcija savienojumi
Silīcija savienojumi Кристаллография
Кристаллография Презентация по Химии "Количество вещества. Моль"
Презентация по Химии "Количество вещества. Моль"  Аналитический подход к моделированию. Физико-химическое моделирование
Аналитический подход к моделированию. Физико-химическое моделирование Основания. Равновесия в растворах
Основания. Равновесия в растворах Электролитическая диссоциация кислот
Электролитическая диссоциация кислот Чистые вещества и смеси
Чистые вещества и смеси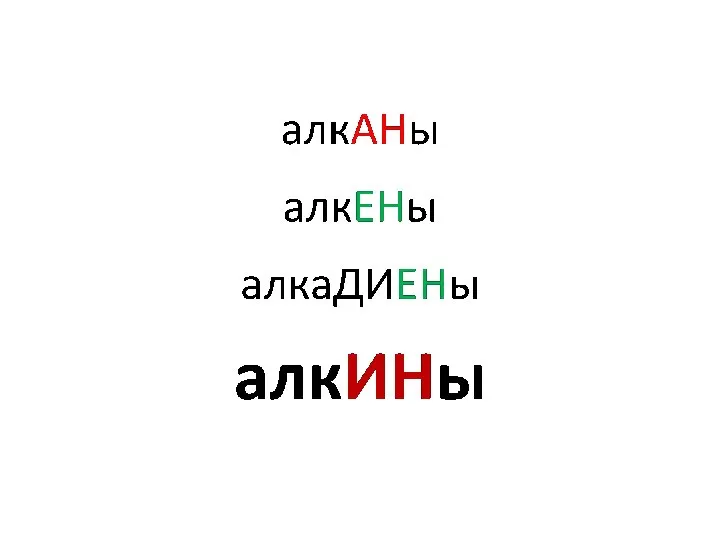 Алкины
Алкины Презентация на тему Неметаллы, особенности строения
Презентация на тему Неметаллы, особенности строения  Практическая работа 1. ХТП. Классификация химических реакций
Практическая работа 1. ХТП. Классификация химических реакций Вымораживание воды
Вымораживание воды HCl - кислота
HCl - кислота Основи масообміну
Основи масообміну Степень окисления в соединениях
Степень окисления в соединениях Физические и химические свойства металлов
Физические и химические свойства металлов Презентация на тему Круговорот углерода в природе
Презентация на тему Круговорот углерода в природе 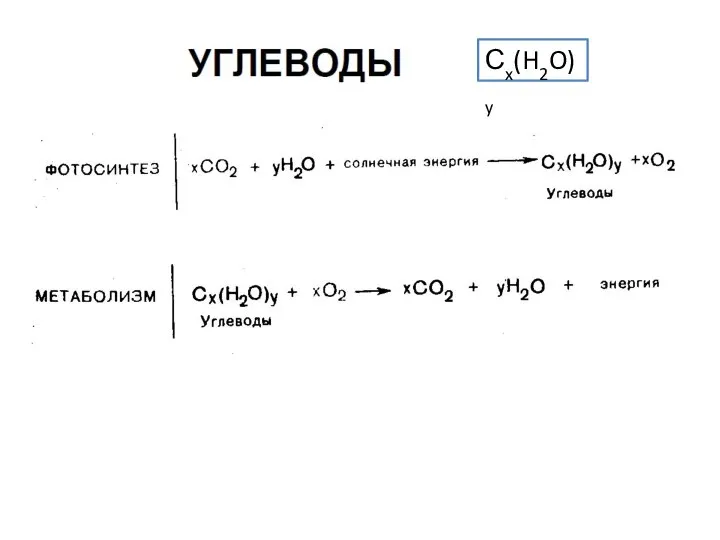 Углеводы. Классификация, cтроение
Углеводы. Классификация, cтроение Железо и его соединения
Железо и его соединения Химические свойства и применение этилена
Химические свойства и применение этилена Ангармоничность и колебательный спектр. Взаимодействия колебаний
Ангармоничность и колебательный спектр. Взаимодействия колебаний