Содержание
- 2. План лекции История и принцип метода Классификация методов гравиметрического анализа Расчет результатов анализа Выбор условий анализа
- 3. История и принцип метода Гравиметрический анализ – классический метод количественного химического анализа, основанный на точном измерении
- 4. Теоретический фундамент закон сохранения массы веществ (А. Лавуазье, 1789); закон эквивалентов (И. Рихтер, 1792); закон постоянства
- 5. Йенс Якоб Берцелиус (1779-1848) Основатель гравиметрического метода анализа. Определил атомные массы 46 элементов. Установил процентный состав
- 6. Классификация методов гравиметрического анализа метод выделения метод отгонки метод осаждения В методе выделения пробу переводят в
- 7. Пример 1. Анализ горных пород на содержание золота. Пример 2. Определение серебра, меди и некоторых других
- 8. В методе отгонки пробу нагревают или обрабатывают кислотами, при этом определяемый компонент выделяется в виде газообразного
- 9. Пример 1. Определение карбонатов 1) СаСО3 → СО2↑ + СаО 2) СО2↑ + СаО = СаСО3↓
- 10. Косвенный метод отгонки основан на измерении убыли массы пробы после отгонки летучего компонента. Пример 1. Для
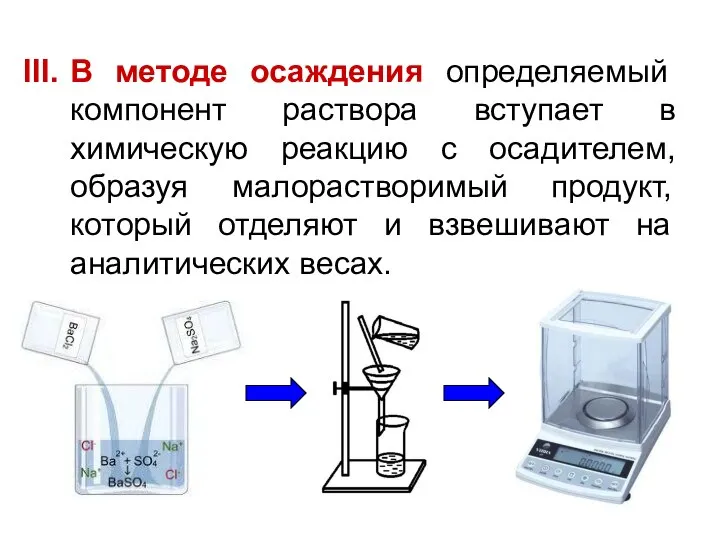
- 11. В методе осаждения определяемый компонент раствора вступает в химическую реакцию с осадителем, образуя малорастворимый продукт, который
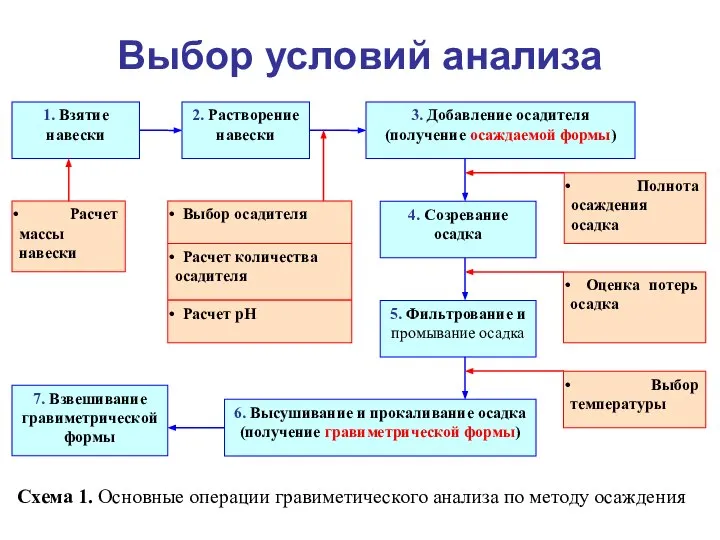
- 12. Основные операции гравиметического анализа по методу осаждения Взвешивание пробы (взятие навески); Растворение навески; Добавление осадителя (получение
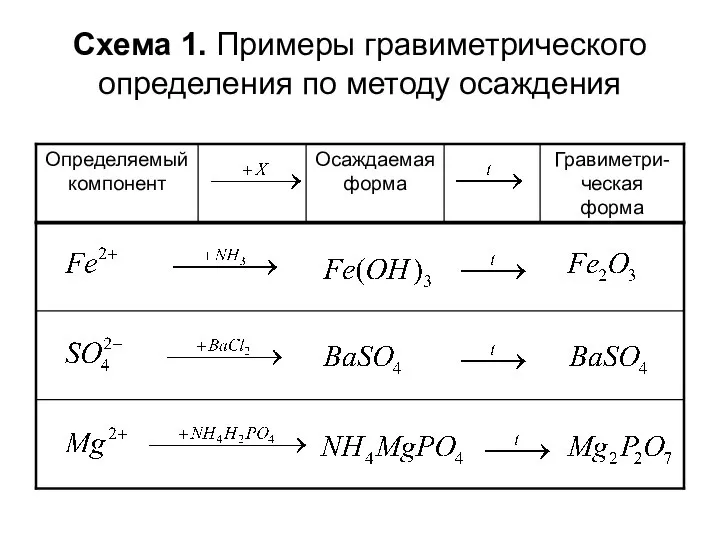
- 13. Схема 1. Примеры гравиметрического определения по методу осаждения
- 14. Расчет результатов анализа Аналитическим сигналом в гравиметрическом анализе является масса гравиметрической формы m(ГФ) определяемого вещества, измеренная
- 15. FX/ГФ – гравиметрический фактор определяемого вещества Х по гравиметрической форме ГФ; М (ГФ) – молярная масса
- 16. Пример 1. Определить гравиметрический фактор железа Fe по оксиду железа (III) Fe2O3. Решение: Ответ:
- 17. Пример 2. Определить гравиметрический фактор смешанного оксида железа (II-III) по оксиду железа (III) Fe2O3. Решение: Ответ:
- 18. Точность вычисления величины F гравиметрического фактора и результата анализа должна соответствовать точности взвешивания. Расчет всегда ведут
- 19. Масса определяемого компонента вычисляется по формуле: Результат анализа – массовая доля определяемого компонента Х в анализируемой
- 20. Выбор условий анализа Схема 1. Основные операции гравиметического анализа по методу осаждения
- 21. Необходимые условия выполнения анализа Расчет массы навески; Выбор осадителя; Расчет количества осадителя; Расчет величины рН в
- 22. Расчет массы навески При получении кристаллического осадка оптимальная масса гравиметрической формы составляет ≈ 0,5 г; При
- 23. Выбор осадителя Осадитель должен быть селективным – реагировать только с определяемым компонентом. Осадитель должен образовывать с
- 24. Расчет количества осадителя необходимого для анализа проводят по уравнению реакции. При этом необходимо знать ориентировочное содержание
- 25. Расчет количества осадителя Расчет количества осадителя необходимого для анализа проводят по уравнению реакции. Необходимо знать: ориентировочное
- 26. Расчет величины рН Величину рН для осаждения гидроксидов и солей слабых кислот рассчитывают, исходя из табличных
- 27. Дано: Найти: pH = ? Решение: Полное осаждение будет при условии: Ответ: рН = 12,39.
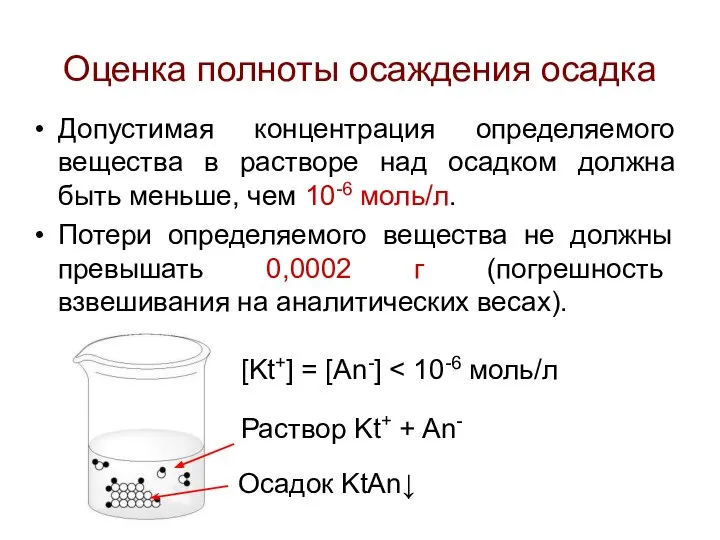
- 28. Оценка полноты осаждения осадка Допустимая концентрация определяемого вещества в растворе над осадком должна быть меньше, чем
- 29. Если осаждаемая форма – ионный осадок бинарного типа KtAn, а избыточная концентрация осадителя равна 10-2 моль/л,
- 30. Оценка потерь осадка Осаждение можно считать полным, а потери – не превышающими допустимый уровень, если масса
- 31. Оценка потерь осадка Потери осадка рассчитывают по формуле: М(ГФ) – молярная масса гравиметрической формы (г/моль); S
- 32. Рис 1. Термогравиметрическая кривая разложения оксалата кальция. Выбор температуры прокаливания осадка Зависимость массы осадка от температуры
- 33. Требования к осаждаемой форме Осадок должен быть малорастворимым, концентрация вещества в надосадочной жидкости не должна превышать
- 34. Осадки легко фильтруются, если они образуются в крупнокристаллической форме. Крупные кристаллы имеют малую поверхность, слабо адсорбируют
- 35. Требования к гравиметрической (весовой) форме Постоянный состав, строго соответству-ющий определенной химической формуле. Химическая устойчивость по отношению
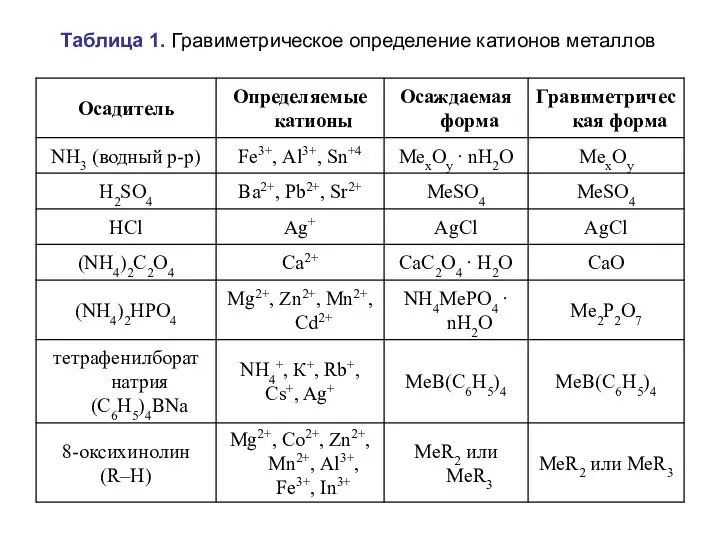
- 36. Таблица 1. Гравиметрическое определение катионов металлов
- 37. Механизмы образования осадков На полноту осаждения влияют: концентрация раствора осадителя; скорость прибавления к анализируемому раствору; температура
- 38. Кристаллические осадки Для малорастворимого соединения: выполняется правило: SMeAn – молярная растворимость Если , т.е. то вещество
- 39. Осадок часто не выпадает из насыщенного раствора, образуется пересыщенный раствор. Концентрация в пересыщенном растворе повышается до
- 40. Образование осадка начинается с формирования центров кристаллизации (зародышевых кристаллов), состоящих всего из нескольких ионов. Пылинки →
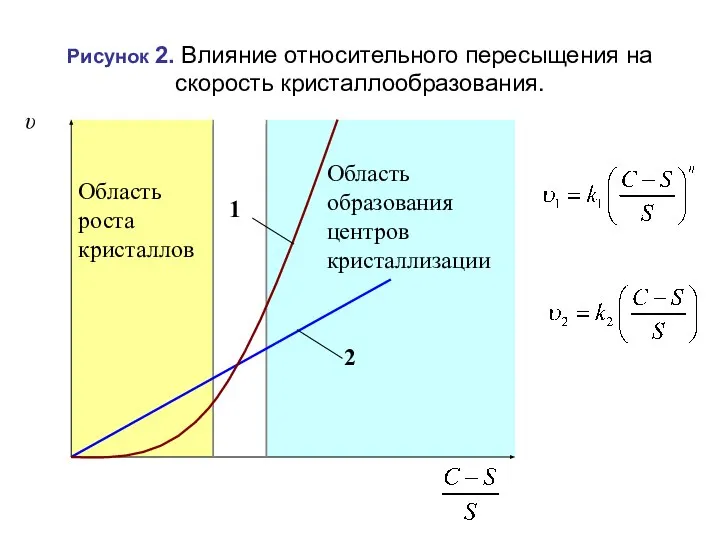
- 41. Скорость образование осадка зависит от относительного пересыщения: υ1 – скорость образование осадка через образование новых центров
- 42. Рисунок 2. Влияние относительного пересыщения на скорость кристаллообразования.
- 43. Для образования крупнокристаллического осадка необходимо уменьшить величину относительного пересыщения, для этого: повысить растворимость осадка (S) через:
- 44. При старении осадка протекают следующие процессы: Мелкие кристаллы растворяются, за их счет растут более крупные кристаллы.
- 45. Осадки, с низкими значениями ПР, получить в крупнокристаллической форме очень трудно. Метод возникающих реактивов (метод осаждение
- 46. Аморфные осадки В аморфном состоянии осаждаются: вещества с очень низким значением ПР: гидроксиды, сульфиды тяжелых металлов
- 47. Образование аморфных осадков происходит через стадию образования коллоидных растворов, в результате их коагуляции. Коллоиды образуются, если
- 48. Аморфные осадки имеют большую удельную поверхность и сильно загрязняются примесями. Уменьшению адсорбции примесей способствует: повышение температуры;
- 49. Загрязнение осадков и борьба с ним Причины загрязнения осадков: Совместное осаждение Последующее осаждение Соосаждение: адсорбция, окклюзия,
- 50. Совместное осаждение Когда произведение концентраций ионов X и Y и ионов осадителя R становится выше соответствующих
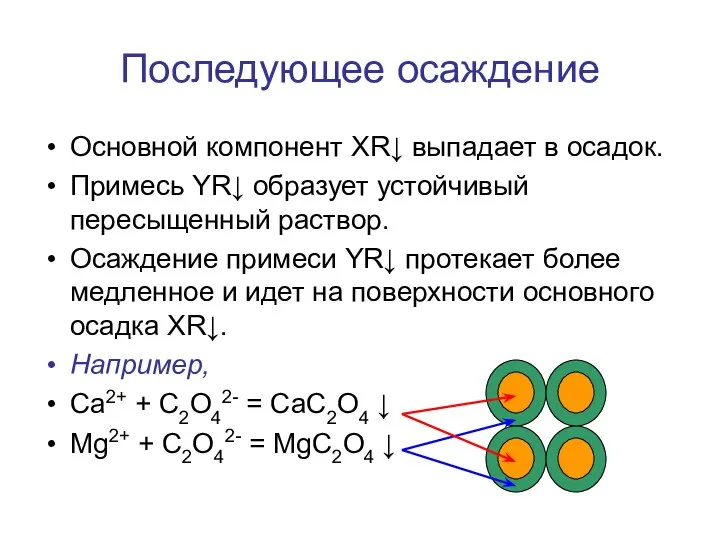
- 51. Последующее осаждение Основной компонент XR↓ выпадает в осадок. Примесь YR↓ образует устойчивый пересыщенный раствор. Осаждение примеси
- 52. Соосаждение Соосаждение – это загрязнение осадка примесями, которые в данных условиях сами не образовывали бы осадок,
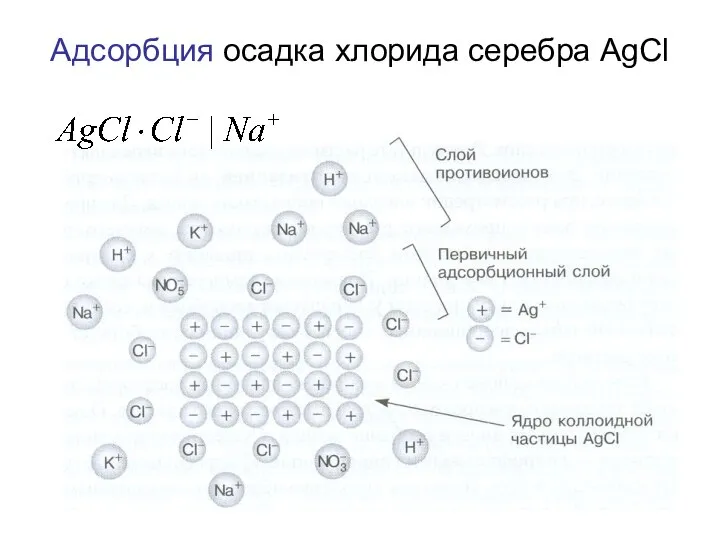
- 53. Адсорбция Адсорбция – это поглощение ионов и молекул поверхностью осадка. Адсорбция характерна для аморфных осадков. Правила
- 54. Адсорбция осадка хлорида серебра AgCl
- 55. Правила Панета-Фаянса-Гана Если в растворе присутствуют разные противоионы, то преимущественно адсорбируются высокозарядные ионы, и те, которые
- 56. Промывание осадка Промывать осадки чистой водой не рекомендуется Промывка водой кристаллических осадков приводит к растворению части
- 57. Промывание осадка При промывании на поверхности осадков происходит обменная адсорбция: ранее адсорбированные ионы замещаются ионами из
- 58. Окклюзия Окклюзия – загрязнение осадка примесями в процессе роста и объединения кристаллов. Причины окклюзии адсорбция ионов
- 59. Уменьшению загрязнения способствует: старение осадка – при этом значительная часть примесей, адсорбированных и инклюдированных мелкими кристаллами,
- 60. Изоморфная сокристаллизация Изоморфная сокристаллизация – образование смешанных кристаллов (твердых растворов) за счет замещения ионов кристаллической решетки.
- 61. Приемы получения чистых осадков При адсорбции (аморфные осадки) - промывают осадок и вытесняют нежелательные примеси. При
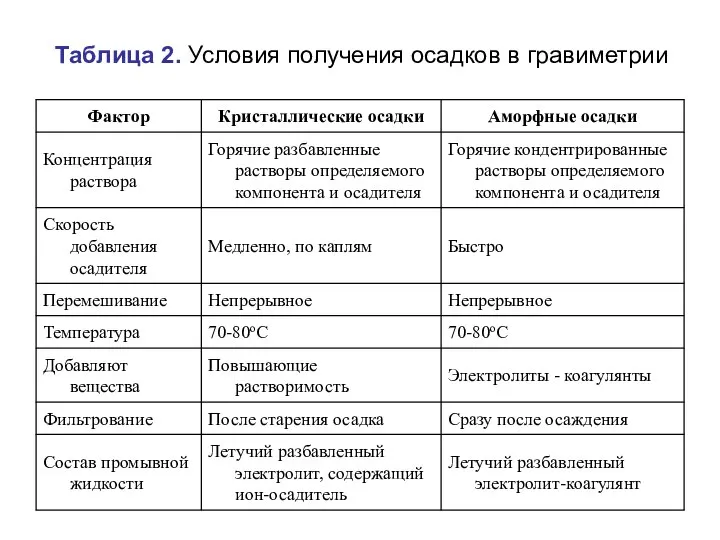
- 62. Таблица 2. Условия получения осадков в гравиметрии
- 64. Скачать презентацию




















































 Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Презентация на тему ОВР в органической химии
Презентация на тему ОВР в органической химии  Презентация на тему Золото
Презентация на тему Золото  Презентация на тему Неметаллы, особенности строения
Презентация на тему Неметаллы, особенности строения  Алгоритм решения задач по химии.
Алгоритм решения задач по химии. Физика полимеров Ч1
Физика полимеров Ч1 Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Алмаз. Свойства алмазов
Алмаз. Свойства алмазов Процесс образования неметаллических включений в стали
Процесс образования неметаллических включений в стали Строение электронных оболочек атомов
Строение электронных оболочек атомов Круговорот серы в природе
Круговорот серы в природе Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции
Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции Французский физик, химик, металловед 1850 - 1936
Французский физик, химик, металловед 1850 - 1936 Что такое электрон?
Что такое электрон? Бериллий, магний и щелечноземельные металлы
Бериллий, магний и щелечноземельные металлы Строение материалов. Дефекты кристаллической структуры
Строение материалов. Дефекты кристаллической структуры Алкены
Алкены Ионные равновесия в растворах
Ионные равновесия в растворах Химическая идентификация основных классов биомолекул
Химическая идентификация основных классов биомолекул Презентация на тему Ковалентная химическая связь
Презентация на тему Ковалентная химическая связь  Природные источники углеводородов
Природные источники углеводородов Металлы
Металлы Презентация на тему Йод
Презентация на тему Йод  Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Тепловой эффект
Тепловой эффект Презентация на тему Углерод
Презентация на тему Углерод  Аммиак NH3
Аммиак NH3 Презентация на тему Щавелевая кислота
Презентация на тему Щавелевая кислота