Слайд 2 Ваша цель:
1.Познакомиться с молярным объемом газов;
2. Изучить основные законы

химии: закон Авогадро, закон Гей – Люссака;
3. Научится решать типовые задачи;
Слайд 3
Девиз урока:
У пространства нет размера, а у знаний нет предела!

Слайд 4
Проверка домашнего задания:

Слайд 6
2. С какими законами вы познакомились на прошлом уроке?

Слайд 7
3. В чем заключается сущность закона сохранения массы веществ?

Слайд 84. Сформулируйте закон постоянства состава и укажите, для каких веществ он всегда

строго выполняется?
Слайд 9
5. Что такое массовая доля и как она рассчитывается?

Слайд 11
Вопрос:
В каких агрегатных состояниях могут находится вещества?

Слайд 13Агрегатное состояние веществ и переходы между ними

Слайд 15 Амедео Авогадро
высказал предположение в 1811 году, что
в одинаковых объемах различных газов

находится одно и тоже число молекул.
Позже эта гипотеза стала законом Авогадро.
Слайд 16 Закон Авогадро:
В равных объемах различных газов при одинаковых условиях (температура,

давление) содержится одинаковое число молекул.
Слайд 17Первое следствие из закона Авогадро:
Одинаковое число молекул различных газов при одинаковых условиях

занимают одинаковый объем.
Слайд 19Молярный объем газа Vm — величина, определяемая отношением объема данной порции газа

V к химическому количеству вещества n в этой порции:
Слайд 20Нормальные условия: температура — 0°С давление — 101,325 кПа

Слайд 21Молярный объем любого газа при нормальных условиях:
Второе следствие из закона Авогадро

Слайд 22Вычисление по уравнению реакции объема газа по известному химическому количеству одного из

веществ
Слайд 23Задача:
Какой объем водорода (н. у.) можно получить при действии соляной кислоты HCl

на цинк химическим количеством 0,5 моль?
Слайд 244. Закон объемных отношений (закон Гей-Люссака):

Слайд 25 Гей-Люссак (1778-1850)
При неизменных температуре и давлении объемы
вступающих в реакцию газов относятся

друг к другу,
а также к объемам образующихся газообразных продуктов
как небольшие целые числа.
Слайд 26Расчет объемных отношений газов по химических уравнениям

Слайд 27Обобщение
Объем газов определяется не размером молекул, а расстоянием между ними, которые

при одинаковых условиях для всех газов примерно одинаковы.
Слайд 28Задача:
Найдите V хлора который потребуется для получения 80 г хлороводорода? какой

V азота имеет такую же массу, что и 40,32 л NH3 (н.у.)?
Слайд 29В равных объемах различных газов при одинаковых условиях (давление, температура) содержится одинаковое

число молекул.
Слайд 30Молярный объем газа есть объем его порции химическим количеством 1 моль. При

нормальных условиях (температура 0°С и давление — 101,325 кПа) молярный объем любого газа является величиной постоянной, равной 22,4 дм3/моль.
Слайд 31Коэффициенты перед газообразными веществами в уравнениях химических реакций соответствуют объемным отношениям этих

веществ.
Слайд 32Закрепление
Какой V (при н. у.) занимают (I вариант) – любой газ химическим

количеством 2 моль, (II - вариант) – азот массой 2 г.
Слайд 33I вариант
Какой объем углерод (IV) – оксида можно получить действием избытка разбавленной

серной кислоты на натрий-карбонат химическим количеством 0,35 моль?
II вариант
Какой объем кислорода потребуется для полного сжигания 200 дм3 (при н.у.) метана и какой объем углерод (IV)-оксида при этом образуется?
Слайд 34Оцените своё состояние после урока
Мне хорошо Как всегда Уныло Я много

знаю Я плохо понял
и умею
Слайд 35Домашнее задание:
§ 5 стр. 29-32, 35-37. Упр. 1-7, 12.


































 Классификация и номенклатура неорганических соединений
Классификация и номенклатура неорганических соединений Комлексті қосылыстардың кұрылысы мен қасиеттерін тусіндіретін теория, енгізген 1893 ж А. Вернер
Комлексті қосылыстардың кұрылысы мен қасиеттерін тусіндіретін теория, енгізген 1893 ж А. Вернер Классификация неорганических веществ
Классификация неорганических веществ Образовательные технологии, используемые на уроках химии для повышения мотивации обучения
Образовательные технологии, используемые на уроках химии для повышения мотивации обучения Презентация на тему Викторина по химии "Что это?"
Презентация на тему Викторина по химии "Что это?"  Основные положения о строении вещества
Основные положения о строении вещества Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1)
Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1) Лекарственные вещества (определения и классификация)
Лекарственные вещества (определения и классификация) Закономерности управления каталитическими процессами. Катализ
Закономерности управления каталитическими процессами. Катализ Присоединение диарилфосфинитов к а-имидоакрилатам
Присоединение диарилфосфинитов к а-имидоакрилатам Удивительный мир химических задач
Удивительный мир химических задач Основания. Определение. Формулы
Основания. Определение. Формулы Пространственное строение органических соединений
Пространственное строение органических соединений 9-8 кислоты в свете ТЭД (1)
9-8 кислоты в свете ТЭД (1)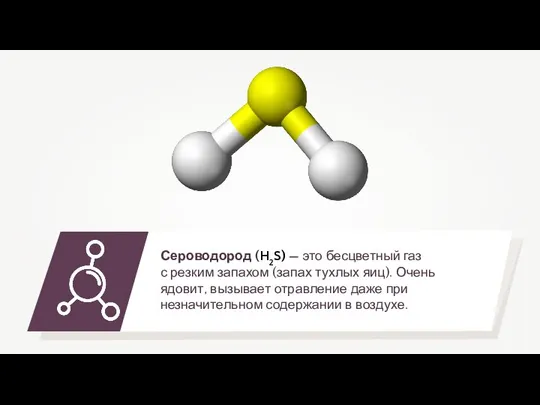 Сероводород
Сероводород Типы химических реакций
Типы химических реакций Азотная кислота
Азотная кислота Особенности органических веществ
Особенности органических веществ Презентация на тему Карбоновые кислоты
Презентация на тему Карбоновые кислоты 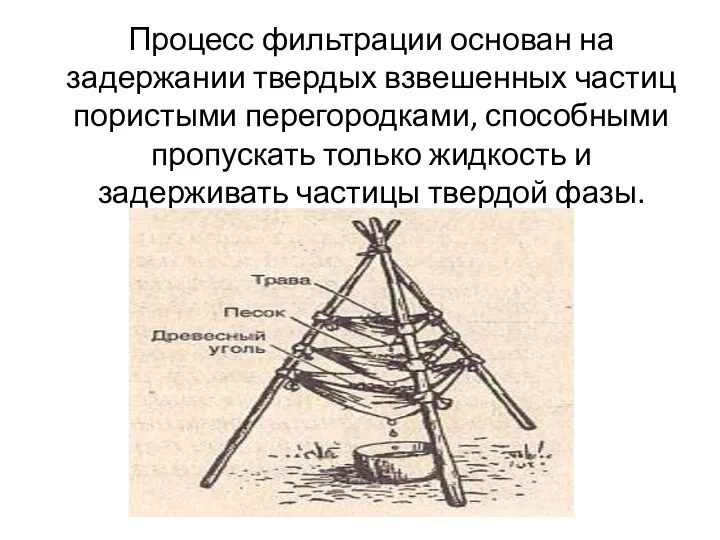 Процесс фильтрации - задержание твердых взвешенных частиц
Процесс фильтрации - задержание твердых взвешенных частиц Щелочные металлы
Щелочные металлы Валентность (от латинского valentia – сила)
Валентность (от латинского valentia – сила) Типы кристаллических решеток
Типы кристаллических решеток Презентация по Химии "Металлы в организме человека"
Презентация по Химии "Металлы в организме человека"  Алкины. Пропин
Алкины. Пропин Гельфильтрация в очистке белков. Принципы биохроматографии
Гельфильтрация в очистке белков. Принципы биохроматографии Кислоты. К уроку по химии для 8 класса
Кислоты. К уроку по химии для 8 класса Химическая связь
Химическая связь