Содержание
- 2. Гидролиз – это обменная реакция между химическим соединением и водой, приводящая к разложению водой исходного вещества.
- 3. Пожалуй, начнем с повторения: Какие процессы являются необратимыми? Какие вещества относят к слабым электролитам? Что такое
- 4. Рассмотрим разные случаи гидролиза
- 5. NO2 K+ OH- H + [ ]- Гидролиз по аниону Каким основанием и какой кислотой (с
- 6. KNO2 + H2O K+ + NO2- + H2O K+ + OH- + HNO2↑ NO2- + H2O
- 7. SO42- H+ [ ]+ Zn 2+ OH - Гидролиз по катиону Каким основанием и какой кислотой
- 8. При протекании первой ступени гидролиза соли многокислотного основания ион цинка вошел в состав более сложного катиона
- 9. (ZnOH)2SO4 + H2O Zn(OH)2 + H2SO4 2ZnOH+ + SO42- + 2H2O 2Zn(OH)2 + 2H+ + SO42-
- 10. Al2S3 H2O + Al(OH)3 + H2S 2 3 6 Гидролиз по катиону и аниону Чем принципиально
- 11. А какой случай стоит еще попробовать?
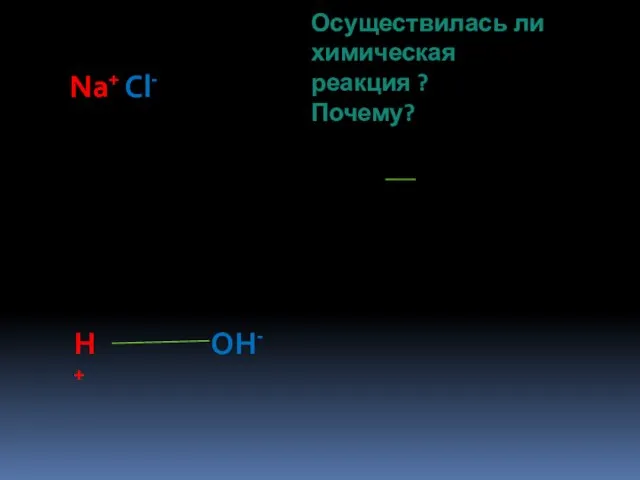
- 12. Na+ Cl- H+ OH- Осуществилась ли химическая реакция ? Почему?
- 13. Можно ли усилить гидролиз? Да, нагреванием. Посмотрим эксперимент: Усиление гидролиза солей при нагревании раствора
- 14. Выводы: Определение гидролиза солей: Взаимодействие в водных растворах катионов и (или) анионов солей с молекулами воды,
- 15. Типы гидролиза: по катиону; по аниону; по катиону и по аниону Выводы:
- 16. Выводы: С точки зрения обратимости: Соли многоосновных кислот и многокислотных оснований диссоциируют Каждая последующая ступень гидролиза
- 17. соли, образованные сильным основанием и слабой кислотой соли, образованные слабым основанием и сильной кислотой соли, образованные
- 18. Кроссворд Заполни пробелы в предложении Найди соответствия
- 19. ИНДИКАТОРЫ (от лат. indicator — указатель) — вещества, позволяющие следить за составом среды или за протеканием
- 20. К слабым электролитам относятся: почти все органические кислоты (CH3COOH, C2H5COOH и др.); некоторые неорганические кислоты (H2CO3,
- 22. Скачать презентацию



![NO2 K+ OH- H + [ ]- Гидролиз по аниону Каким основанием](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/889537/slide-4.jpg)

![SO42- H+ [ ]+ Zn 2+ OH - Гидролиз по катиону Каким](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/889537/slide-6.jpg)












 Основания. Классификация
Основания. Классификация Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук.
Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук. Изменения в составе ядра атома Задачи урока: Познакомиться с понятием «ядерные процессы», «изотопы» Развить понятие «Химически
Изменения в составе ядра атома Задачи урока: Познакомиться с понятием «ядерные процессы», «изотопы» Развить понятие «Химически Презентация на тему Нитраты и организм человека
Презентация на тему Нитраты и организм человека  Стехиометрические законы химии
Стехиометрические законы химии Презентация на тему Химические антонимы
Презентация на тему Химические антонимы  Основные положения теории строения органических соединений А. М. Бутлерова. Многообразие органических соединений
Основные положения теории строения органических соединений А. М. Бутлерова. Многообразие органических соединений Карбоксилденген этоксилаттар
Карбоксилденген этоксилаттар Лекция1Тов
Лекция1Тов Обобщение знаний об углеводородах
Обобщение знаний об углеводородах Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения физические и химические явления
физические и химические явления Получение металлов
Получение металлов Тренажер. Химические свойства солей
Тренажер. Химические свойства солей Классификация органических соединений
Классификация органических соединений Алюминий
Алюминий Фосфорорганические соединения
Фосфорорганические соединения Комплексные соединения
Комплексные соединения proekt_TTU_15 (1)
proekt_TTU_15 (1) Основные классы неорганических соединений (урок - семинар)
Основные классы неорганических соединений (урок - семинар) Білім алушылардың мектеп жасынан бастап экологиялық мәдениетін қалыптастыру үшін волонтерлар клубын ашу
Білім алушылардың мектеп жасынан бастап экологиялық мәдениетін қалыптастыру үшін волонтерлар клубын ашу Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Кетоны. Номенклатура
Кетоны. Номенклатура Применение серы
Применение серы Интересные факты о химических элементах
Интересные факты о химических элементах Гидроксиды металлов
Гидроксиды металлов Химическая связь в молекулах. Экзаменационные вопросы
Химическая связь в молекулах. Экзаменационные вопросы 9_OSNOVY_KOLANALIZA (1)
9_OSNOVY_KOLANALIZA (1)