Содержание
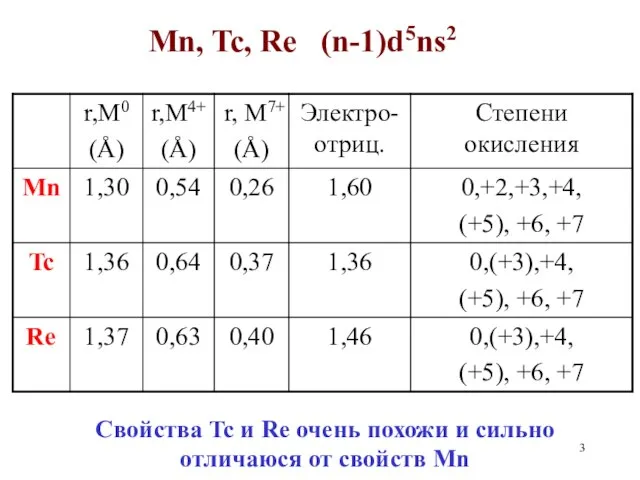
- 3. Mn, Tc, Re (n-1)d5ns2 Свойства Tc и Re очень похожи и сильно отличаюся от свойств Mn
- 4. Содержание в земной коре и минералы Mn – 15 место. Пиролюзит – рис. слева (MnO2.xH2O); браунит
- 5. Tc – первый искусственный элемент, 97Tc: t1/2 = 2,6.106 лет. Re – 81 место, ОЧЕНЬ редкий
- 6. Открытие элементов Mn – в 1774 г. шведы Шееле и Ган. Мангановый камень (пиролюзит) ремесленники добавляли
- 7. Получение простых веществ Дешевый метод MnO2 + Fe2O3 +5C = Mn + 2Fe + 5CO Дорогой
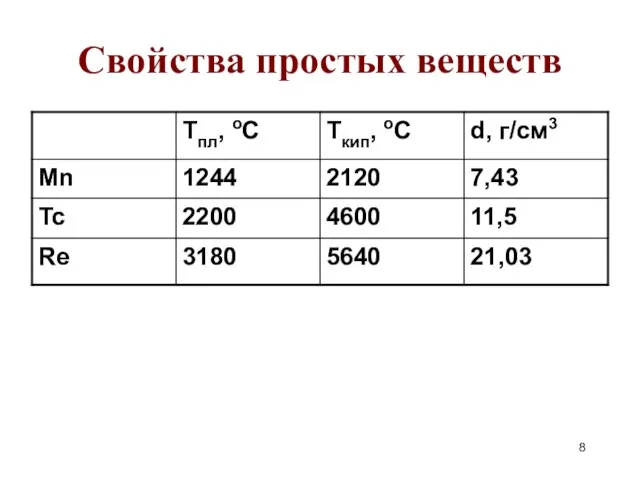
- 8. Свойства простых веществ
- 9. Хим. cвойства простых веществ Положение в ряду напряж. металлов ….Mg Mn Zn…H Cu Tc Re… Mn
- 10. Реакции при нагревании 3Mn + 2O2 = Mn3O4 (MnIIMnIII2O4) 3Mn + N2 = Mn3N2 (1200oC) Mn
- 11. Кислородные соединения M7+ M2О7 +Н2О = 2НMО4 Сильные кислоты, сила уменьшается в ряду Mn-Tc-Re HMnO4 нестабильна
- 12. Соли M7+ 2KMnO4 = K2MnO4 + MnO2 + O2↑ 2MnO4– + 5H2S + 6H+ = 2Mn2+
- 13. KMnO4 как окислитель Конпропорционирование 3MnSO4 + 2KMnO4 + 2H2O = 5MnO2↓ + K2SO4 + 2H2SO4
- 14. Получение KMnO4 Две стадии: 1) Щелочное плавление пиролюзита: 3MnO2 + KClO3 + 6KOH = 3K2MnO4 +
- 15. Кислородные соединения Mn6+ MnO3 и H2MnO4 – не известны Соли – манганаты (зеленый цвет) Манганаты склонны
- 16. Кислородные соединения Mn6+ Манганаты – сильные окислители, особенно в кислой среде, где восстанавливаются до Mn2+; в
- 17. Кислородные соединения Mn4+ MnO2 – важнейшее соединение Свойства окислителя (при нагревании): MnO2 + 4HClконц = MnCl2
- 18. Кислородные соединения Mn4+ Слабовыраженные амфотерные свойства MnO2 + 4HF = MnF4 + 2H2O MnO2 + CaO
- 19. Кислородные соединения Mn2+ MnO – серо-зеленый, не растворим в воде MnCO3 = MnO + CO2 (при
- 20. Соли Mn2+ Водорастворимые соли: MnCl2.4H2O, MnSO4.5H2O, Mn(NO3)2.6H2O – в водных р-рах [Mn(H2O)6]2+ Не растворимые соли: MnCO3,
- 22. Скачать презентацию















![Соли Mn2+ Водорастворимые соли: MnCl2.4H2O, MnSO4.5H2O, Mn(NO3)2.6H2O – в водных р-рах [Mn(H2O)6]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/842411/slide-19.jpg)
 Решение задач
Решение задач Строение твердых и жидких металлов. Зональная ликвация
Строение твердых и жидких металлов. Зональная ликвация Сера и ее соединения
Сера и ее соединения Проверочные работы по темам: Неметаллы. 9 класс
Проверочные работы по темам: Неметаллы. 9 класс Нефть. Черное золото или черная смерть
Нефть. Черное золото или черная смерть Закалка без полиморфного превращения
Закалка без полиморфного превращения Диссоциация оснований, кислот, солей
Диссоциация оснований, кислот, солей Презентация на тему Отравляющие вещества
Презентация на тему Отравляющие вещества  Полимеры
Полимеры Основы кристаллографии
Основы кристаллографии Классификация химических реакций
Классификация химических реакций Азот
Азот Основные понятия и законы химии
Основные понятия и законы химии Разбор ДЗ. Титрование – общие моменты
Разбор ДЗ. Титрование – общие моменты Кислород
Кислород Строение атома
Строение атома Алкены (непредельные углеводороды)
Алкены (непредельные углеводороды) Bool-doser team
Bool-doser team Химия природная или синтетическая. За и против
Химия природная или синтетическая. За и против задачи
задачи Тема: Неметаллы
Тема: Неметаллы Особо чистые вещества. Занятие 12
Особо чистые вещества. Занятие 12 Презентация на тему Серебро
Презентация на тему Серебро  Дисперсные системы
Дисперсные системы Свойства металлов, способы получения, их нахождение в природе, основные областях применения
Свойства металлов, способы получения, их нахождение в природе, основные областях применения Типы химических реакций
Типы химических реакций Гидролиз солей
Гидролиз солей Приключение кислорода
Приключение кислорода