Слайд 2План лекции
I. Основные понятия и определения
II. Классификация ограниченно растворимых жидкостей
III. Диаграммы состояния

ограниченно растворимых жидкостей, правила их построения и свойства:
1. с верхней критической температурой растворения;
2. с нижней критической температурой растворения;
3. с верхней и нижней критической температурой растворения;
4. без критических температур растворения.
IV. Принципиальные особенности взаимно нерастворимых жидкостей
V. Перегонка с водяным паром
VI. Трёхкомпонентные системы. Экстракция
VII. Закон распределения Нернста-Шилова
Слайд 3Компетенции
ОК-1, ОПК-7
Знать:
физико- химическую сущность процессов, происходящих при образовании ограниченно растворимых жидкостей;
Уметь:
описывать

состав и свойства диаграмм состояния ограниченно растворимых жидкостей;
применять закон распределения для проведения экстракции
Владеть:
Навыками построения и описания свойств диаграмм состояния ограниченно растворимых жидкостей
Слайд 4Бинарные системы жидкостей с ограниченной растворимостью
Ограниченно растворимые жидкости
Жидкости, растворимость которых зависит от

условий растворения, называются ограниченно растворимыми.
В пределах определенных концентраций они образуют одну гомогенную фазу;
в другой области концентраций и температур система становится гетерогенной.
По характеру зависимости взаимной растворимости от температуры жидкости делят на четыре типа:
1. с верхней критической температурой растворения;
2. с нижней критической температурой растворения;
3. с верхней и нижней критической температурой растворения;
4. без критических температур растворения.
Слайд 5Бинарные системы жидкостей с ограниченной растворимостью
Изучение взаимной растворимости проводят с помощью диаграмм

состояния в координатах температура – состав при р = const.
Диаграммы позволяют определить составы жидких лекарственных форм, не расслаивающихся при хранении.
Для построения диаграмм готовят ряд смесей известного состава в широком интервале концентраций.
Каждую смесь, находящуюся в запаянной пробирке, медленно нагревают и при постоянном встряхивании определяют температуру, при которой мутная смесь превращается в прозрачный гомогенный раствор.
Найденные температуры растворения смесей наносят на диаграмму и соединяют плавной кривой, выражающей зависимость температуры растворения от состава смеси. Полученная кривая называется кривой растворения или кривой расслоения.
Слайд 61. Ограниченно растворимые жидкости с верхней критической температурой растворения
(фенол-вода, анилин-вода)
Если при температуре

t к воде добавлять небольшими порциями анилин при встряхивании, то сначала будет существовать гомогенный раствор. В точке а кривой расслоения водный раствор
достигает насыщения анилином. При дальнейшем добавлении анилина система расслаивается на два слоя вследствие образования нового слоя – насыщенного раствора воды в анилине, состав которого при температуре t определяется точкой в.
По мере роста температуры границы растворимости сближаются и область расслаивания уменьшается. В некоторых случаях можно достичь такой температуры, выше которой жидкости смешиваются в любых соотношениях. Эта температура называется верхней критической температурой растворения (tкр).
Рис. 1. Диаграмма состояния ограниченно растворимых жидкостей с верхней критической температурой растворения.
Слайд 7Ограниченно растворимые жидкости с верхней критической температурой растворения
(фенол-вода, анилин-вода)
Кривая АК показывает

зависимость состава водного слоя от температуры, а кривая КВ – зависимость анилинового слоя от температуры.
По мере роста температуры увеличивается взаимная растворимость анилина в воде и воды в анилине. Любая точка на рис. 1, лежащая под кривой растворимости, т.е. в внутри области расслаивания (например. точка с), соответствует гетерогенной смеси.
Область выше кривой АКВ соответствует гомогенному составу.
Прямая ав, соединяющая равновесные насыщенные при данной температуре растворы, называется коннодой. Если исходная смесь имеет состав, определяемый точкой с, то при температуре t по правилу рычага соотношение масс слоев составов а (водный слой) и в (анилиновый слой) определяется соотношением отрезков конноды вс и са:
Слайд 82. Ограниченно растворимые жидкости с нижней критической температурой растворения
(триэтиламин-вода, диэтиламин-вода).
Для таких систем

по мере понижения температуры характерно увеличение взаимной растворимости компонентов.
Точки, отвечающие концентрациям равновесных насыщенных растворов, сближаются с понижением температуры и сливаются в одну критическую точку К. Ниже критической температуры растворения tкрН наступает неограниченная растворимость, т.е. при дальнейшем понижении температуры компоненты неограниченно взаимно растворяются.
Рис. 2. Диаграмма состояния ограниченно растворимых жидкостей с нижней критической температурой растворения
Слайд 93. Ограниченно растворимые жидкости с верхней и нижней критическими температурами растворения (никотин-вода, глицерин-гваякол)
У

жидкостей этого типа наименьшая взаимная растворимость при температуре t, затем растворимость растет и при увеличении и при уменьшении температуры.
Для них характерны две критические температуры растворения. Выше tкрВ и ниже tкрН наступает неограниченная растворимость компонентов в друг друге.
Рис. 3. Диаграмма состояния ограниченно растворимых жидкостей с верхней и нижней критической температурой растворения
Слайд 104. Ограниченно растворимые жидкости без критических температур растворения
(эфир-вода)
Существуют системы, для которых не удается

достичь ни нижней, ни верхней критических температур растворения.
Например, в системе диэтиловый эфир-вода при -3,80С слой, состоящий из насыщенного раствора эфира в воде замерзает, и ниже этой температуры существует только раствор, содержащий ≈ 1% (мас.) воды в эфире. Поэтому достигнуть нижней критической температуры не удается. При 200С эфирный слой содержит ≈ 2% (мас.) воды, достигает критической температуры, выше которой в виде жидкости существует только водный раствор эфира, т.к. выше этой температуры эфир испаряется.
Рис. 4. Диаграмма состояния ограниченно растворимых жидкостей без критических температур растворения.
Таким образом, критические температуры смешения достичь не удается и кривая остается незамкнутой (рис. 4).
Слайд 11Взаимно нерастворимые жидкости
Практически нерастворимы друг в друге.
Компоненты бинарной жидкой смеси сильно

различаются по своей природе.
Например, вода—масло, вода—бензол, вода-ртуть.
Принципиальные особенности:
1) так как в смеси жидкости находятся в виде однородных мультимолекулярных структур (например, в виде капель из молекул одного типа), то присутствие одной жидкости не влияет на давление пара другой (в отличие от взаимно растворимых жидкостей). Т.е., независимо от состава смеси давление пара каждого компонента — то же, что и для чистого компонента.
Пузырьки пара, образующиеся при закипании смеси, содержат пары обоих веществ. Поэтому закипание наступает тогда, когда с внешним давлением сравняется общее давление обоих паров:
Слайд 12Взаимно нерастворимые жидкости
2) температура кипения смеси ниже температуры кипения любого компонента
Рис.

5. Зависимость давления пара над взаимно нерастворимыми жидкостями от температуры.
Рис. 5. Диаграмма кипения идеального бинарного раствора (Т – Х диаграмма) (лекция 2).
Для взаимно же растворимых жидкостей (исключая азеотропные смеси) температура кипения смеси, как видно из диаграммы рис. 5 (лекции 2), находится в интервале между температурами кипения отдельных компонентов:
Слайд 13Взаимно нерастворимые жидкости
Например, у воды и у скипидара давление паров достигает атмосферного,

соответственно, при следующих температурах:
а совокупное давление паров этих веществ сравнивается с атмосферным при:
(в широком диапазоне состава смеси); т.е., действительно, смесь закипает при более низкой температуре, чем любой чистый компонент.
Слайд 14Перегонка с водяным паром
Метод очистки органических жидкостей от примесей основан на том,

что температура кипения смеси ниже температуры кипения любого чистого компонента.
Многие органические вещества при своей температуре кипения разлагаются. При смешивании с водой температура кипения смеси становится ниже, чем даже у воды, и органическое вещество уже выдерживает кипячение.
Последовательность операций:
1) смесь испаряют (при этом загрязняющие вещества в пар не переходят).
2) пар конденсируют;
образующаяся жидкая фаза расслаивается на две фазы — воду и органическую жидкость (практически чистую).
3) органический слой отделяют и высушивают. Соотношения масс жидкостей в конденсате рассчитывают по формуле:
где РВ* и Р0* – соответственно давление насыщенных паров воды и перегоняемой жидкости при температуре кипения смеси.
Левая часть формулы представляет собой расходный коэффициент пара. Этот коэффициент численно равен массе водяного пара, необходимого для перегонки единицы массы перегоняемого вещества.
Слайд 15
Перегонка с водяным паром
Расходный коэффициент пара тем больше, чем меньше давление насыщенного

пара перегоняемой жидкости и чем меньше ее молярная масса (Мо).
Состав паровой фазы над взаимно нерастворимыми жидкостями не зависит от массы жидкостей, а массовая доля перегоняемой жидкости в паре будет тем больше, чем меньше молярная масса и давление пара второй жидкости.
Поэтому второй жидкостью обычно служит вода с относительно высокой температурой кипения 1000С и небольшой молярной массой 18 г/моль.
При помощи водяного пара отгоняют бензол из каменноугольной смолы, очищают анилин и нафталин от примесей; отделяют эфирные масла, извлекаемые из цветов.
Слайд 16Трёхкомпонентные системы. Экстракция
Если в равновесную систему, состоящую из двух несмешивающихся жидкостей, добавить

третий компонент, то он распределится в них в определённом соотношении.
Образуется трёхкомпонентная система: две несмешивающиеся жидкости и распределенный между ними третий компонент.
Например, в смесь четыреххлористого углерода и воды, добавить йод, то он будет растворяться в воде и CCl4 до тех пор, пока не установится динамическое равновесие между фазами.
Это термодинамическое равновесие между двумя жидкими фазами 1 и 2 наступает при равенстве химических потенциалов третьего компонента в обеих фазах:
Рис. 6 Трёхкомпонентная система
Слайд 17Закона распределения
Так как стандартные химические потенциалы μ01 и μ02 постоянны, то постоянно

и отношение активностей третьего компонента в фазах, т.е. (2)
Равенство (2) является выражением закона распределения: «Отношение равновесных активностей третьего компонента в двух взаимно несмешивающихся жидкостях при постоянной температуре есть величина постоянная, называемая термодинамической константой распределения».
В законе распределения в числителе - активность третьего компонента в органической фазе, а в знаменателе – активность в фазе неорганической.
Константа распределения К0 зависит от температуры и природы всех трех компонентов, но не зависит от концентрации распределяемого вещества.
Слайд 19Закона распределения
При диссоциации или ассоциации растворенного вещества устанавливается сложное равновесие между простыми

и ассоциированными молекулами или ионами в пределах каждой фазы. Для этих случаев закон распределения приближенно можно выразить:
где αI и αII – степени диссоциации или ассоциации растворяемого вещества в I (органической) и II (водной) фазах соответственно.
Метод экстракции основан на распределении вещества между двумя несмешивающимися растворителями.
Экстракция – это процесс извлечения растворенного вещества из раствора при помощи другого растворителя (экстрагента), который не смешивается с первым и лучше растворяет извлекаемое вещество.
Слайд 20Экстракция
Экстракцию широко применяют в фармации для извлечения из растительного сырья эфирных масел,
алкалоидов и других физиологических активных веществ.
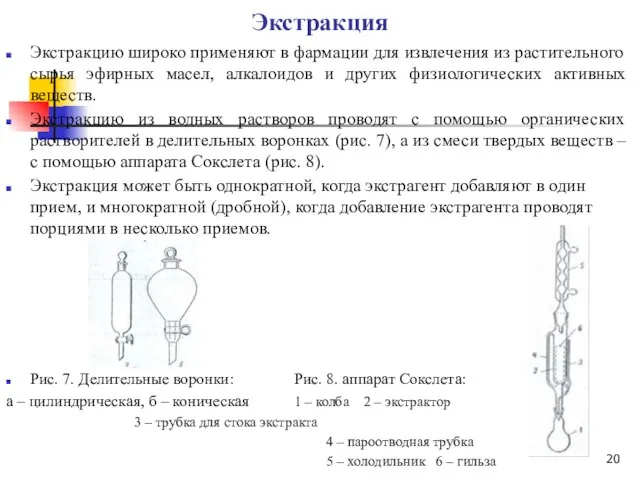
Экстракцию из водных растворов проводят с помощью органических растворителей в делительных воронках (рис. 7), а из смеси твердых веществ – с помощью аппарата Сокслета (рис. 8).
Экстракция может быть однократной, когда экстрагент добавляют в один прием, и многократной (дробной), когда добавление экстрагента проводят порциями в несколько приемов.
Рис. 7. Делительные воронки: Рис. 8. аппарат Сокслета:
а – цилиндрическая, б – коническая 1 – колба 2 – экстрактор
3 – трубка для стока экстракта
4 – пароотводная трубка
5 – холодильник 6 – гильза
Слайд 21Экстракция
Однократная экстракция
Эффективность экстракции.
Обозначим: VI — объем первой жидкости (где изначально находилось экстрагируемое

вещество), VII — объем второй жидкости (с помощью которой осуществляется экстракция). И будем считать, что в обеих жидкостях коэффициенты активности вещества близки к единице: γI ≈ γII ≈ 1,0.
Тогда при равновесии
Масса вещества в каждой из фаз:
чем больше К и VII, тем больше масса экстрагированного вещества (mII).
Дробная экстракция
— разделить объем VII на n равных частей: экстрагировать сначала одной частью и удалить фазу II, добавить очередную порцию экстрагента, вновь ее удалить — и т.д.
Тогда, например, в формулах второй экстракции вместо m0 следует ставить то количество вещества, которое осталось в фазе I после первой экстракции.
при росте числа экстракций (при том же общем объеме экстрагента) количество вещества, остающегося в первой жидкости, становится всё меньше, т. е. дробная экстракция эффективней, чем простая.
Слайд 22Список литературы
Физическая химия: учебник / Ю.Я. Харитонов. – М.: ГЭОТАР - Медиа,

2013. – 608 с. http://www.studentlibrary.ru/book/ISBN9785970423 905.html
Евстратова К.И. Физическая и коллоидная химия / К. И. Евстратова, Н. А. Купина, Е. Е. Малахова. – М.: Высшая школа, 1990. -487 с.
Мушкамбаров Н.Н. Физическая и коллоидная химия: учеб. для студентов мед. вузов / Н.Н. Мушкамбаров. – М.: - ГЭОТАРМЕД, 2001. -384 с.
Мушкамбаров Н.Н., Физическая и коллоидная химия: учебник для медицинских вузов (с задачами и решениями) [Электронный ресурс] учебник для медицинских вузов (с задачами и решениями). / Мушкамбаров Н.Н. - 4-е изд., стер. - М. : ФЛИНТА, 2015. - 455 с.: http://www.studentlibrary.ru/book/ISBN97859976522954.html





















 Растворы, классификация растворов
Растворы, классификация растворов Углеводы. Общие представления об углеводах
Углеводы. Общие представления об углеводах Олеиновая кислота
Олеиновая кислота Химическая промышленность. Аварии на химических предприятиях
Химическая промышленность. Аварии на химических предприятиях Техносферная безопасность. Химия как наука
Техносферная безопасность. Химия как наука Амины
Амины Жиры. Техническая переработка жиров
Жиры. Техническая переработка жиров Кислоты. Тест
Кислоты. Тест Понятие электродного потенциала и методы его измерения
Понятие электродного потенциала и методы его измерения Химия крови. Состав и функции крови
Химия крови. Состав и функции крови Щелочноземельные металлы
Щелочноземельные металлы Аргентум, или серебро
Аргентум, или серебро Единый государственный экзамен по ХИМИИ (консультация 3) О.П. Костенко, проректор ГОУ РК «ИПК РО» по НМР
Единый государственный экзамен по ХИМИИ (консультация 3) О.П. Костенко, проректор ГОУ РК «ИПК РО» по НМР Сырье, продукты, параметры гидроочистки
Сырье, продукты, параметры гидроочистки Карбоновые кислоты. Тест. 10 класс
Карбоновые кислоты. Тест. 10 класс Массовая доля химического элемента
Массовая доля химического элемента Предельные углеводороды
Предельные углеводороды Именем Менделеева Д.И названы
Именем Менделеева Д.И названы Соли, их классификация и свойства
Соли, их классификация и свойства Валентность
Валентность Степень окисления
Степень окисления Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны
Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны Презентация на тему Полимеразная цепная реакция (ПЦР)
Презентация на тему Полимеразная цепная реакция (ПЦР)  Вебинар. Задачи из домашек по 27-29 задачам
Вебинар. Задачи из домашек по 27-29 задачам Презентация на тему Железо и его соединения (9 класс)
Презентация на тему Железо и его соединения (9 класс)  Химические уравнения
Химические уравнения Трансляция. Активирование аминокислоты
Трансляция. Активирование аминокислоты Кислоты и соли
Кислоты и соли