Слайд 2Рост химического производства – экологические проблемы: много химико-технологических процессов протекают в растворах.

Требования к растворителям:
нетоксичность, взрывобезопасность, невоспламеняемость, термическая устойчивость и др.
ИЖ – новый класс химических соединений – растворители «Зеленой химии»
Слайд 3Химическая технология
Наиболее перспективные растворители
в химической технологии
вода,
сверхкритические жидкости,
перфторуглероды,
ионные жидкости.

Слайд 4Определение ИЖ
Соли, состоящие из органического катиона и органического или неорганического аниона с

низкими температурами плавления (tплавл. < 100 oC)
Слайд 5СОСТАВ ИЖ: КАТИОНЫ
В качестве катионов в ИЖ чаще всего используются:
тетраалкиламмоний [NR4]+,

тетраалкилфосфоний [PR4]+, диалкилимидазолий [CnMIm]+ ,
алкилпиридиний [CnPy]+
и некоторые другие.
Слайд 6СОСТАВ ИЖ: АНИОНЫ
тетрафторборат [ВF4]–,
гексафторфосфат [PF6]–,
трифторметан сульфонат [CF3-SO3]–
(сокращенно трифлат) (ОТf–),
![СОСТАВ ИЖ: АНИОНЫ тетрафторборат [ВF4]–, гексафторфосфат [PF6]–, трифторметан сульфонат [CF3-SO3]– (сокращенно трифлат)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1103143/slide-5.jpg)
бис {(трифторметан) сульфонил} имид
[CF3-SO2-N-SO2-CF3] ([NTf2]–),
простые анионы Cl–, Вr–, I–),
сложные анионы NO3–, ClO4–, CF3COO– и др.
Слайд 7Графические формулы катионов ИЖ
Тетраалкиламмоний [NR4]+
Тетраалкилфосфоний [РR4]+
![Графические формулы катионов ИЖ Тетраалкиламмоний [NR4]+ Тетраалкилфосфоний [РR4]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1103143/slide-6.jpg)
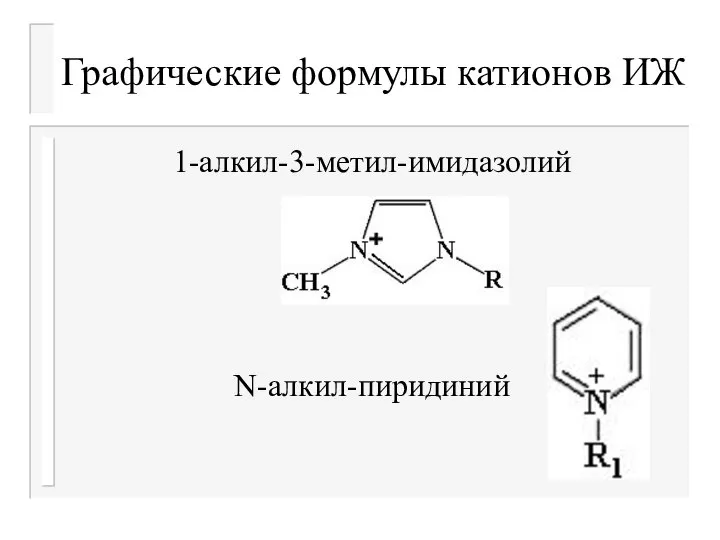
Слайд 8Графические формулы катионов ИЖ
1-алкил-3-метил-имидазолий
N-алкил-пиридиний
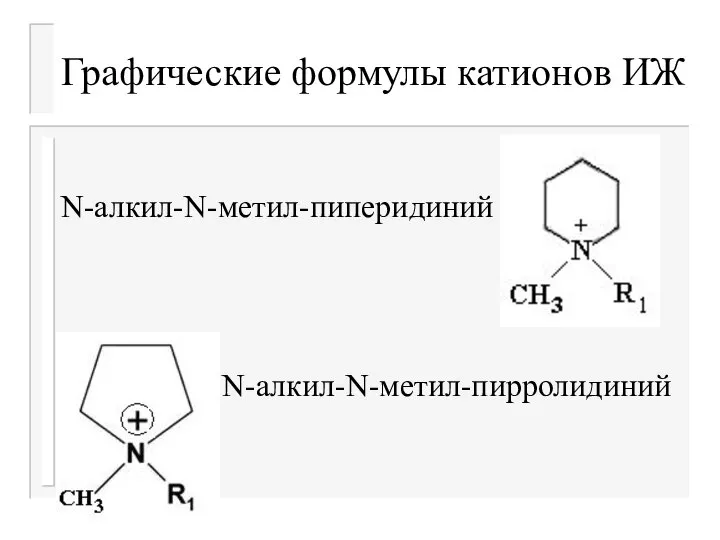
Слайд 9Графические формулы катионов ИЖ
N-алкил-N-метил-пиперидиний
N-алкил-N-метил-пирролидиний
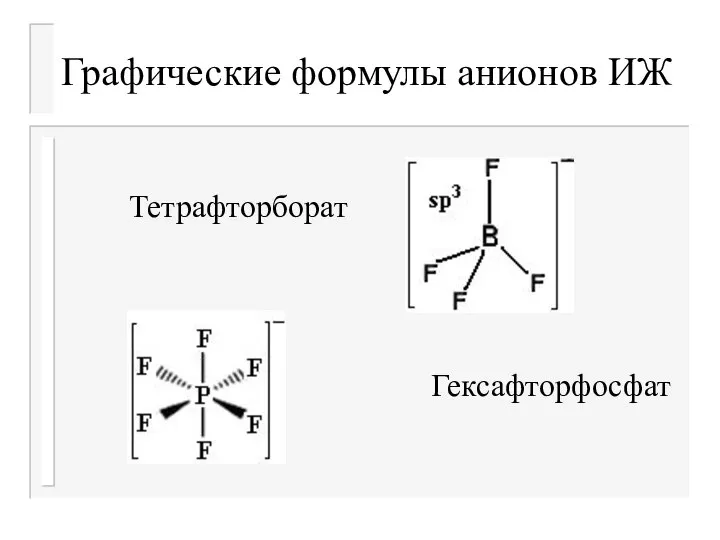
Слайд 10Графические формулы анионов ИЖ
Тетрафторборат
Гексафторфосфат
Слайд 11Графические формулы анионов ИЖ
Бис(трифторметан)сульфонилимид, [NTf2]
Трифторметан сульфонат (или трифлат), [OTf]
![Графические формулы анионов ИЖ Бис(трифторметан)сульфонилимид, [NTf2] Трифторметан сульфонат (или трифлат), [OTf]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1103143/slide-10.jpg)
Слайд 12Графические формулы анионов ИЖ
Гексафторантимонат
Дицианамид [DCA]–
![Графические формулы анионов ИЖ Гексафторантимонат Дицианамид [DCA]–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1103143/slide-11.jpg)
Слайд 13Ионные расплавы
Теоретически к ионным жидкостям также могут быть отнесены расплавы неорганических солей.

Считается, что при высоких температурах соли практически полностью диссоциируют на ионы:
NaCl –(t=780 oC)→ Na+ + Cl–
Слайд 14Получение ионных жидкостей
Проводится подбор органического катиона и аниона таким образом, чтобы tпл.<100oC.
Получение

ионных жидкостей проводится в две стадии: синтез катиона, и обмен аниона
(когда это необходимо).
Слайд 15Получение ионных жидкостей
Два типа реакций:
1. Прямая реакция галогенидных солей с кислотами Льюиса:
[EMIm]+Cl−

+ AlCl3 → [EMIm] +[AlCl4]−
2. Обмен (метатезис) анионов с образованием ИЖ, которые можно отделить:
[EMIm]+Cl− + H[PF6] → [EMIm]+[PF6]− + HCl
[EMIm]+[PF6]− – гидрофобная ИЖ,
HCl отделяется промывкой водой
Слайд 16Получение [BMIm][NTf2]
1-бутил-3-метилимидазолий бис {(трифторметил)сульфонил}имид
Получается обменом анионами из водных растворов [BMIm]Cl
![Получение [BMIm][NTf2] 1-бутил-3-метилимидазолий бис {(трифторметил)сульфонил}имид Получается обменом анионами из водных растворов [BMIm]Cl](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1103143/slide-15.jpg)
и Li[NTf2]:
[BMIm]Cl + Li[NTf2]изб. = [BMIm] [NTf2] +LiCl
Гидрофобная ИЖ экстрагируется дихлорметаном, который потом отгоняется под вакуумом. Аналогичным образом получаются [BMIm][OTf] и [OMIm][OTf]
Слайд 17Очистка ионных жидкостей
Невозможно очистить перегонкой (давление их паров практически равно нулю). На

практике очищают исходные соединения, из которых собираются получать ионную жидкость.
Теоретически можно отогнать любые органические примеси из ионной жидкости, так как многие из последних устойчивы к нагреванию до очень высоких температур: не разлагаются вплоть до 400 °C.
Слайд 18Очистка ионных жидкостей
Можно очистить ионные жидкости активированным углем, с последующей фильтрацией через

колонку, заполненную оксидом алюминия.
Предлагаются также различные инновационные методы:
экстракция суперкритическим CO2 ;
мембранная очистка.
Слайд 19Осушка ионных жидкостей
Особенность ИЖ – ГИГРОСКОПИЧНОСТЬ
Интенсивно поглощают воду из воздуха,
что приводит к

изменению свойств ИЖ.
Воду отгоняют нагреванием в течение нескольких часов до 60 °C при пониженном давлении в вакуумном сушильном шкафу
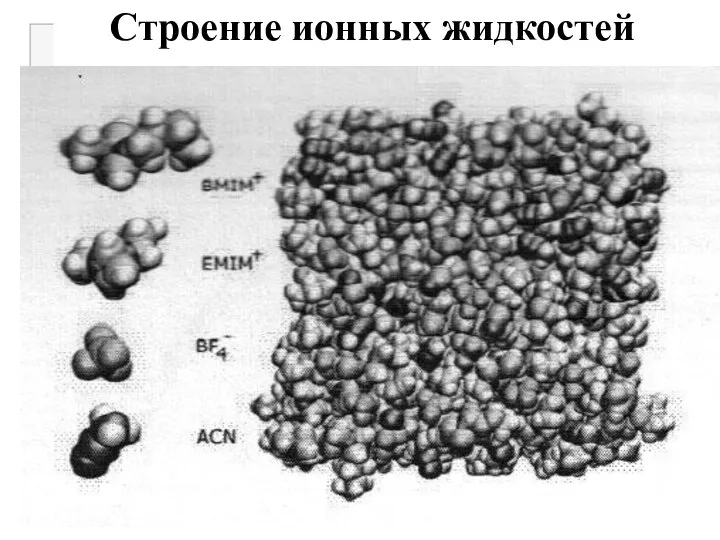
Слайд 20Строение ионных жидкостей
ИЖ имеют сложное строение в виде трехмерных сеток. Водородная связь

между анионом и протонами имидазольного кольца может влиять на ионную упаковку, вязкость и температуру плавления. Присутствие длинной алкильной цепи на первом атоме азота имидазольного кольца препятствует кристаллизации этих ионных жидкостей.
Слайд 22СВОЙСТВА ИЖ
1. Жидкости в широком интервале to:
(от –100 до +

300 – 400 °C).
2. Термически устойчивы вплоть до температур 300 – 400 °C.
3. Давление паров мало – не летучи.
4. Не горючи – пожаробезопасны.
5. Проводят электрический ток.
Слайд 23СВОЙСТВА ИЖ
6. Хорошие растворители для органических, неорганических и полимерных материалов
7. Обладают

высокой сольватирующей способностью – можно использовать в малых количествах.
8. Обладают лиофильными свойствами (высокое химическое сродство к органическим веществам)
9. Проявляют каталитические свойства.
10. В зависимости от состава: гидрофильны и гидрофобны
11. Высокая вязкость при низких температурах
Слайд 24Растворимость
Хорошо растворяются в спиртах, ацетоне, ацетонитриле, ДМСО и других органических растворителях.
Гидрофобные

- плохая растворимость в воде (но гигроскопичны)
Гигроскопичность – важнейший недостаток ИЖ; кроме того – высокая вязкость и стоимость.
Слайд 25СВОЙСТВА ИЖ
Подбирая состав ИЖ можно в широких пределах изменять свойства ИЖ:
[BMIm][AlCl4] и

[BMIm][PF6] – гидрофобны;
[BMIm]CH3COO и [BMIm][BF4] – гидрофильны (растворимы в воде).
Слайд 26Термическая стабильность
Разложение ИЖ протекает по одному механизму как на воздухе, так

и в среде азота – при нагревании на воздухе окисления ИЖ не происходит.
[BMim][NTf2] +423; [BMim][OTf] +409;
[BMim][РF6] +433; [BMim][BF4] +425 оС
Слайд 27Температура плавления
Влияние длины алкильной цепи на температуру плавления 1-алкил-3-метилимидазольных [PF6]
![Температура плавления Влияние длины алкильной цепи на температуру плавления 1-алкил-3-метилимидазольных [PF6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1103143/slide-26.jpg)
Слайд 28Проводимость ИЖ
Удельная ЭП большинства ИЖ при комнатной температуре изменяется в диапазоне 0,1

- 20 мСм/см.
Наибольшая ЭП у ИЖ на основе катиона 1-этил-3-метилимидазолия [EtMeIm]+ ≈10.
ИЖ на основе катионов тетраалкиламмония, пирролидиния, пиперидиния, и пиридиния характеризуются значительно более низкими значениями ЭП (0,1-5 мСм/см).
Слайд 29Проводимость водных растворов
Для сравнения.
Водные растворы электролитов:
29,4 мас.% водный раствор КОН 540

мСм/см (батареи щелочных аккумуляторов).
Свинцовый аккумулятор - (30 мас.% водный раствор серной кислоты), - 730 мСм/см.
ЭП неводных растворов примерно на один порядок ниже, чем проводимость соответствующих водных растворов
Слайд 30Проводимость чистых ИЖ
ЭП растворов прямо пропорциональна числу заряженных частиц и обратно пропорциональна

вязкости. Отличительной чертой ИЖ является то, что это вещество является одновременно электролитом и растворителем. Если предположить, что, как и расплавы неорганических солей, ИЖ состоят только из ионов, то проводимость ИЖ была бы существенно выше. Значит степень диссоциации ИЖ невелика.
Слайд 31Проводимость чистых ИЖ
Значит ионы противоположного знака, которые в ионных жидкостях находятся достаточно

близко друг от друга, образуют относительно стабильные агрегаты (нейтральные подсистемы), которые не могут быть проводниками электрического тока.
Степень диссоциации в чистых ИЖ пока определить не представляется возможным.
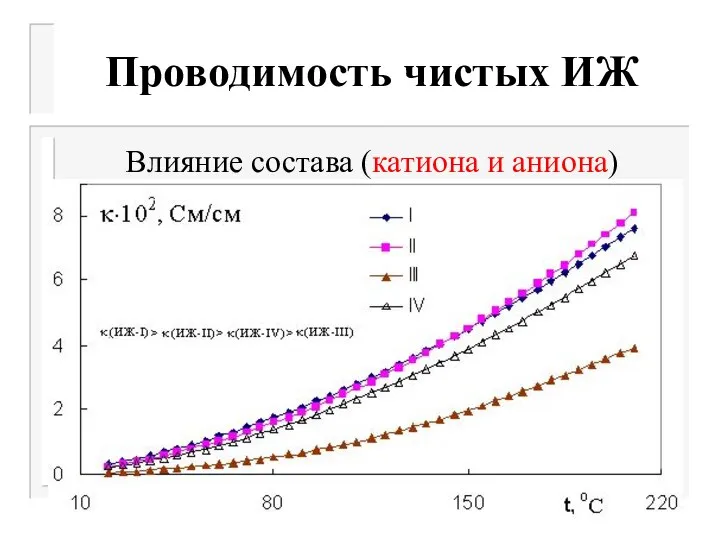
Слайд 33Проводимость чистых ИЖ
Влияние состава (катиона и аниона)
Слайд 34Проводимость растворов ИЖ
Разбавление чистых ионных жидкостей полярными растворителями приводит к увеличению наблюдаемой

удельной электропроводности (ЭП). Например, удельная ЭП чистой [EtMeIm][BF4] составляет 14 мСм/см, в то время как раствор с концентрацией 2 моль/л в ацетонитриле – 47 мСм/см.
Слайд 35Проводимость растворов ИЖ
Один из наиболее проводящих растворов [Et4N][BF4] в ацетонитриле, применяемый в
![Проводимость растворов ИЖ Один из наиболее проводящих растворов [Et4N][BF4] в ацетонитриле, применяемый](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1103143/slide-34.jpg)
двухслойных конденсаторах, характеризуется проводимостью 60 мСм/см.
Слайд 36Проводимость растворов ИЖ
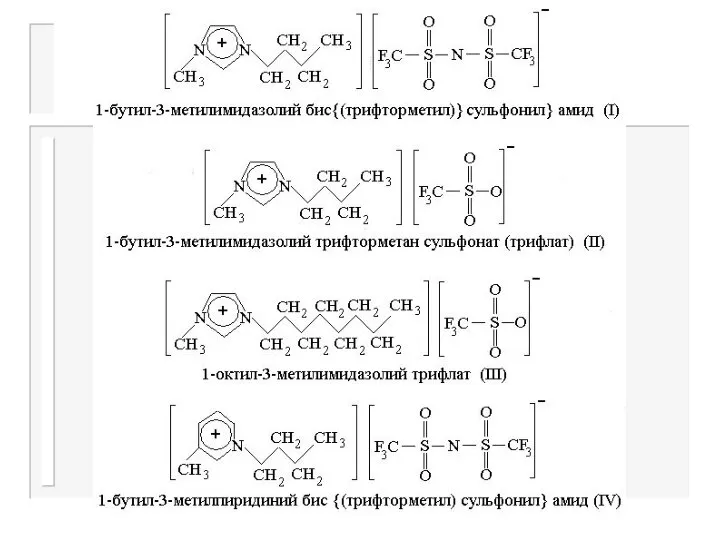
Зависимость удельной ЭП ИЖ- IV в ацетонитриле от концентрации
κmax(ИЖ-I)
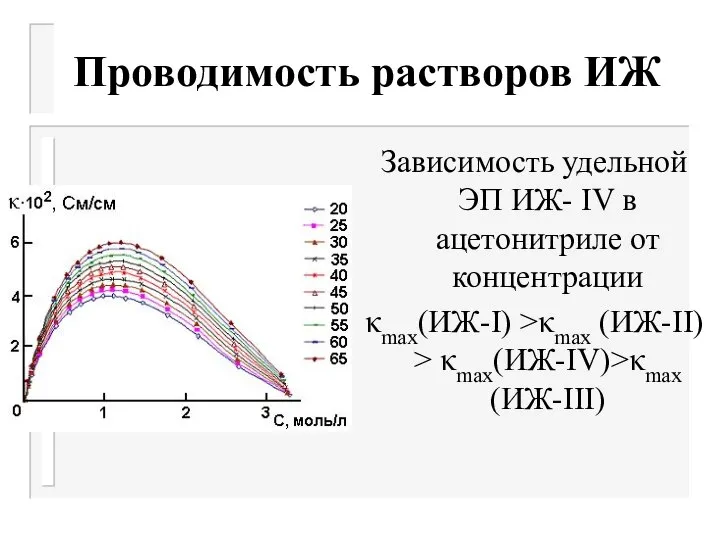
>κmax (ИЖ-II) > κmax(ИЖ-IV)>κmax (ИЖ-III)
Слайд 37Проводимость растворов ИЖ
Зависимость приведенной ЭП ацетонитрильных растворов ионных жидкостей I-IV от приведенной
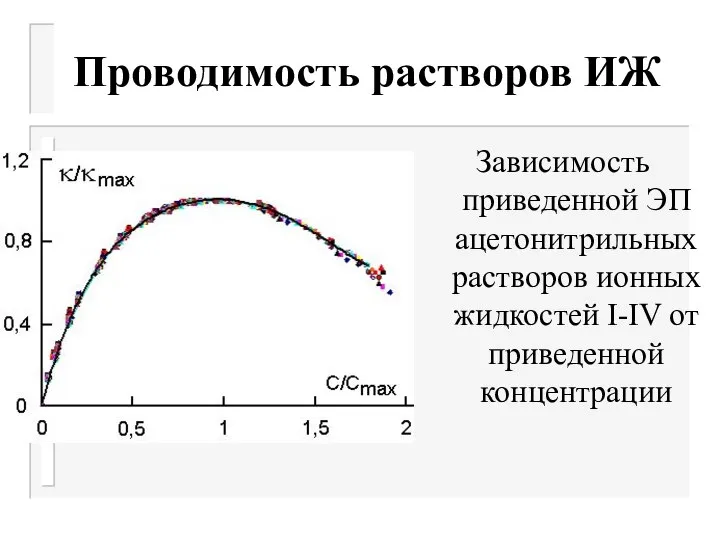
концентрации
Слайд 38Разбавленные растворы ИЖ
1-бутил-3-метилпиридиний бис {(трифторметил) сульфонил} имид – ДМСО
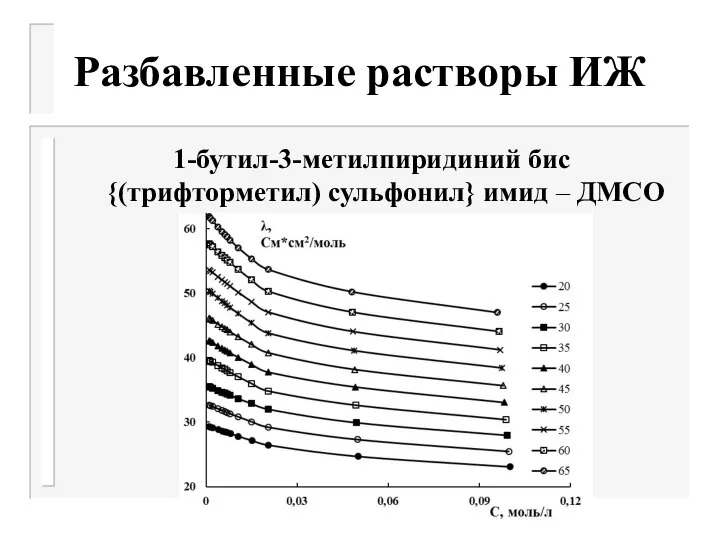
Слайд 39Разбавленные растворы ИЖ
1-бутил-3-метилпиридиний бис {(трифторметил) сульфонил} имид – ДМСО
t, оC Λ0, См·см2/моль Ka
20 30,6±0,1 1,46±0,50

40 46,0±0,2 2,00±0,50
60 61,4±0,3 2,56±0,50
Слайд 40Вязкость ИЖ
Для ИЖ характерны достаточно высокие значения вязкости (обычно порядка 30-50 сП),

но в некоторых случаях их вязкость намного выше, например, 500-600 сП. Поскольку большинство органических растворителей имеют относительно низкую вязкость, то разбавление вязкой ИЖ молекулярным растворителем уменьшает вязкость смеси, что также приводит к увеличению проводимости.
Слайд 41Применение ИЖ
Первыми стали использовать ионные жидкости в качестве растворителей химики-органики. Выяснилось, что

процессы алкилирования и аллилирования в ИЖ протекают более эффективно, чем в традиционных растворителях (диметилсульфоксид, дихлорметан).
Слайд 421. Применение ИЖ
Ионные жидкости являются так называемыми «дизайнерскими растворителями». Смысл этого заключается

в том, что для каждой реакции, возможно синтезировать и приспособить растворитель для ее оптимизации.
Слайд 431. Применение ИЖ
Химическая промышленность в настоящее время использует около 600 молекулярных растворителей.

Комбинируя катионы и анионы можно создать из ионных жидкостей миллионы «дизайнерских» растворителей - во много раз большее, чем число известных традиционных органических растворителей.
Слайд 441. Применение ИЖ
Варьирование кислотности среды путем изменения состава ИЖ позволяет существенным образом

повысить селективность, скорость и процент выхода реакции Дильса-Альдера (получение диенов с образованием шестичленного цикла).
Слайд 451. Применение ИЖ
Ряд органических реакций изучен в ионных жидкостях. Самые важные типы:
Альдольная

конденсация. Восстановление. Галогенирование. Диазотирование.
Дильс-Альдер. Нитрование. Олигомеризация. Окисление (воздухом и/ или кислородом).
Полимеризация. Сульфирование. Фридель-Крафтс. Хиральное гидрирование.
N-алкилирование и О-алкилирование.
Слайд 462. Применение ИЖ
Изучение комплексообразования в ионных жидкостях показало, что с использованием ИЖ

можно осуществить процессы окисления, гидрирования, полимеризации и другие целенаправленные реакции. Топливные элементы с С4С1Im[BF4] в качестве электролита работает с очень высокой эффективностью даже при комнатной температуре.
Слайд 473. Применение ИЖ
В настоящее время активно идет разработка новых методов очистки углеводородного

сырья от соединений серы. Установлено, что некоторые ионные жидкости эффективно адсорбируют алифатические сульфиды из нефти и моторных топлив.
Слайд 483. Применение ИЖ
Причем, после использования легко осуществляется регенерация ИЖ путем их нагревания

или экстракции сульфидов водой.
Слайд 494. Применение ИЖ
Перспективным является применение в литиевых источниках тока и других электрохимических

устройствах также смесей ионных жидкостей.
Для подбора подходящих для этой цели ИЖ исследована ЭП двух- и трехкомпонентных смесей ИЖ. Установлено, что добавление второго и третьего компонентов существенным образом (в два – четыре раза) увеличивает ЭП смеси.
Слайд 504. Применение ИЖ
Синергетический эффект существенного повышения ЭП отмечается при смешении двух ионных

жидкостей: N-метил-N-пропил-пирролидиний бис(фторсульфонил)имида, N-бутил-N-метил-пирролидиний бис(трифторметансульфонил)имида и гексафторфосфата лития (LiPF5)
Слайд 515. Применение ИЖ
Производство биоразлагаемых материалов
Применяются, как правило, легколетучие органические растворители, что приводит

к загрязнению окружающей среды.
Альтернативными растворителями в процессах «Зеленой химии» могут стать ионные жидкости.
Слайд 525. Применение ИЖ
ИЖ используются в качестве компонентов полимерной матрицы, способной растворять органические

и неорганические вещества, в том числе и природные макромолекулы (например, хитин, хитозан, целлюлозу и лигнин). Высокопористый хитин, например, успешно получается при использовании в качестве растворителя ацетата
1-бутил-3-имидазолия.
Слайд 536. Применение ИЖ
Магнитные ионные жидкости (МИЖ) были получены двумя способами: твердофазной реакцией
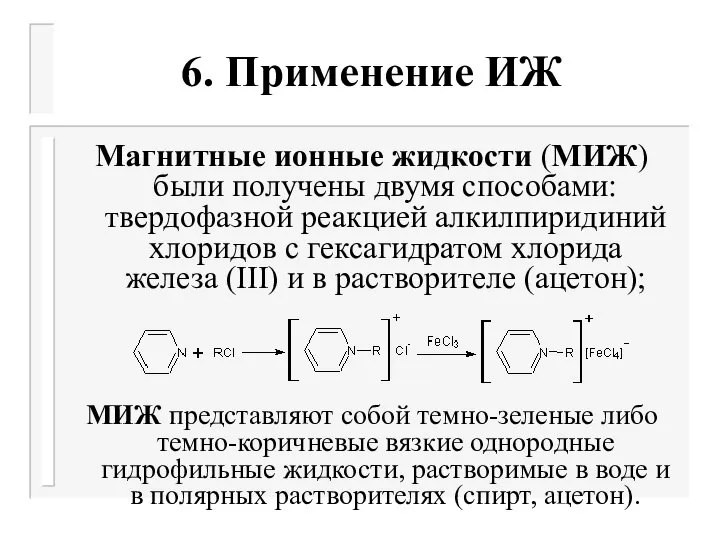
алкилпиридиний хлоридов с гексагидратом хлорида железа (III) и в растворителе (ацетон);
МИЖ представляют собой темно-зеленые либо темно-коричневые вязкие однородные гидрофильные жидкости, растворимые в воде и в полярных растворителях (спирт, ацетон).
Слайд 547. Применение ИЖ
Изучается также возможность использования ионных жидкостей в процессах переработки ядерных

отходов.
Слайд 55Расплавы неорганических солей
В качестве ионных жидкостей можно рассматривать также и расплавы

неорганических солей.
при температуре, превышающей 800оС, NaCl является типичной ионной жидкостью. Этот класс соединений достаточно хорошо изучен – исследованы такие свойства расплавов солей как плотность, вязкость, электропроводность и др.




![СОСТАВ ИЖ: АНИОНЫ тетрафторборат [ВF4]–, гексафторфосфат [PF6]–, трифторметан сульфонат [CF3-SO3]– (сокращенно трифлат)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1103143/slide-5.jpg)
![Графические формулы катионов ИЖ Тетраалкиламмоний [NR4]+ Тетраалкилфосфоний [РR4]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1103143/slide-6.jpg)



![Графические формулы анионов ИЖ Бис(трифторметан)сульфонилимид, [NTf2] Трифторметан сульфонат (или трифлат), [OTf]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1103143/slide-10.jpg)
![Графические формулы анионов ИЖ Гексафторантимонат Дицианамид [DCA]–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1103143/slide-11.jpg)



![Получение [BMIm][NTf2] 1-бутил-3-метилимидазолий бис {(трифторметил)сульфонил}имид Получается обменом анионами из водных растворов [BMIm]Cl](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1103143/slide-15.jpg)









![Температура плавления Влияние длины алкильной цепи на температуру плавления 1-алкил-3-метилимидазольных [PF6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1103143/slide-26.jpg)






![Проводимость растворов ИЖ Один из наиболее проводящих растворов [Et4N][BF4] в ацетонитриле, применяемый](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1103143/slide-34.jpg)




















 Магний и его сплавы
Магний и его сплавы Решение задач по органической химии
Решение задач по органической химии Эвапориты. Химические осадки из ионных растворов
Эвапориты. Химические осадки из ионных растворов Железо. Физические свойства
Железо. Физические свойства Строение атома
Строение атома Chemsheets AS 1009 (Electron arrangement)
Chemsheets AS 1009 (Electron arrangement) Аммиак. Соли аммония
Аммиак. Соли аммония Периодический закон, 9 класс (1)
Периодический закон, 9 класс (1) Минералы
Минералы Термопласты: основные представители, сравнение свойств и область их применения
Термопласты: основные представители, сравнение свойств и область их применения Химические явления. Закон сохранения массы веществ
Химические явления. Закон сохранения массы веществ Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Теория строения химических соединений
Теория строения химических соединений Классификация органических соединений. Урок химии в 10 классе
Классификация органических соединений. Урок химии в 10 классе Способы защиты химического оборудования от коррозии
Способы защиты химического оборудования от коррозии Золь. Свойства золи
Золь. Свойства золи Тематическая викторина Химические элементы, металлы и неметаллы
Тематическая викторина Химические элементы, металлы и неметаллы Химический состав молока
Химический состав молока Алканы. Свойства. Строение и применение
Алканы. Свойства. Строение и применение Аналитический подход к моделированию. Физико-химическое моделирование
Аналитический подход к моделированию. Физико-химическое моделирование Чистые вещества и смеси
Чистые вещества и смеси Предмет химии. Вещества
Предмет химии. Вещества Алюминий. 9 класс
Алюминий. 9 класс Контроль качества лекарственных средств, производных карбоновых кислот и аминокислот
Контроль качества лекарственных средств, производных карбоновых кислот и аминокислот Биохимия. Основные классы соединений. Аминокислоты и Белки
Биохимия. Основные классы соединений. Аминокислоты и Белки Основные сведения о строении атома. Состав атомных ядер
Основные сведения о строении атома. Состав атомных ядер Химические элементы
Химические элементы Амины
Амины