Содержание
- 2. Что же такое химия и что она изучает? Химия – это наука о веществах, их свойствах
- 3. История химии Зачатки химии возникли ещё со времён человека разумного. Человек всегда так или иначе имел
- 4. Разделы химии Современная химия – очень обширная область естествознания. Многие её разделы представляют собой самостоятельные, хотя
- 5. Содержание 1. Основные понятия химии. Атом. Молекула. Вещество. 2. Классификация неорганических веществ. Соли. Кислоты. Основания. Оксиды.
- 6. Атом Атом - мельчайшая, химически неделимая частица вещества, которая является носителем его свойств. Атомы соединяются при
- 7. Молекула Молекула – наименьшая частица вещества, образованная при слиянии двух и более атомов, способная существовать самостоятельно
- 8. Оксиды Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. Классификация оксидов: -
- 9. Вещество Вещество – это то, из чего состоят физические тела. Тела могу состоять из одного и
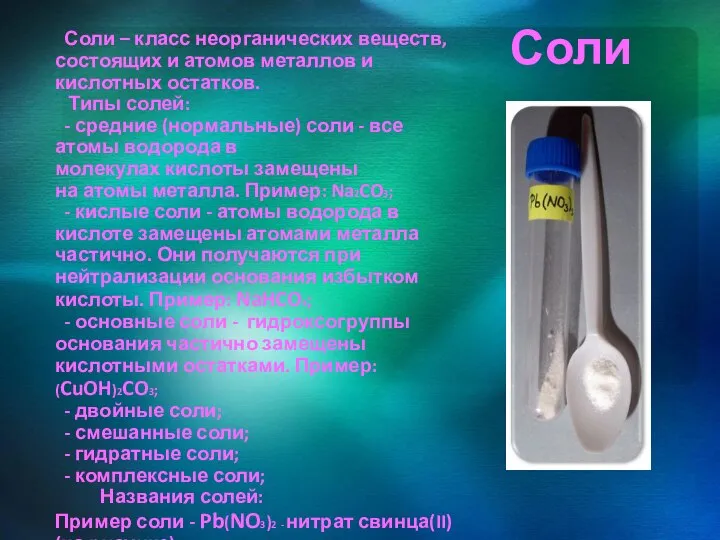
- 10. Соли Соли – класс неорганических веществ, состоящих и атомов металлов и кислотных остатков. Типы солей: -
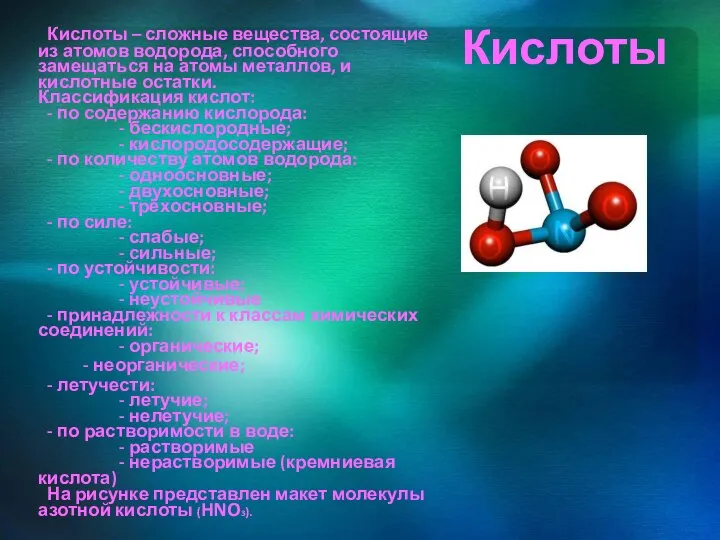
- 11. Кислоты Кислоты – сложные вещества, состоящие из атомов водорода, способного замещаться на атомы металлов, и кислотные
- 12. Основания Основания – группы сложных веществ, состоящих из атомов металлов и гидроксогрупп. Основания классифицируются по: -
- 13. Периодическая система химических элементов Д.И.Менделеева К середине XIX века были открыты 63 химических элемента. Учёными неоднократно
- 15. Скачать презентацию
Слайд 2Что же такое химия и что она изучает?
Химия – это наука
Что же такое химия и что она изучает?
Химия – это наука

Слайд 3История химии
Зачатки химии возникли ещё со времён человека разумного. Человек всегда так
История химии
Зачатки химии возникли ещё со времён человека разумного. Человек всегда так

Использовались окислительно-восстановительные реакции, не протекающие в живой природе — например, восстановление металлов из их соединений.
Слайд 4 Разделы химии
Современная химия – очень обширная область естествознания. Многие её
Разделы химии
Современная химия – очень обширная область естествознания. Многие её

Слайд 5Содержание
1. Основные понятия химии. Атом. Молекула. Вещество.
2. Классификация неорганических веществ.
Соли.
Содержание
1. Основные понятия химии. Атом. Молекула. Вещество.
2. Классификация неорганических веществ.
Соли.

Слайд 6Атом
Атом - мельчайшая, химически неделимая частица вещества, которая является носителем его
Атом
Атом - мельчайшая, химически неделимая частица вещества, которая является носителем его

Слайд 7 Молекула
Молекула – наименьшая частица вещества, образованная при слиянии двух и более
Молекула
Молекула – наименьшая частица вещества, образованная при слиянии двух и более

Слайд 8 Оксиды
Оксиды – сложные вещества, состоящие из двух элементов, один из
Оксиды
Оксиды – сложные вещества, состоящие из двух элементов, один из

Слайд 9 Вещество
Вещество – это то, из чего состоят физические тела.
Тела могу состоять
Вещество
Вещество – это то, из чего состоят физические тела. Тела могу состоять

Слайд 10 Соли
Соли – класс неорганических веществ, состоящих и атомов металлов и
Соли
Соли – класс неорганических веществ, состоящих и атомов металлов и
Слайд 11 Кислоты
Кислоты – сложные вещества, состоящие из атомов водорода, способного замещаться
Кислоты
Кислоты – сложные вещества, состоящие из атомов водорода, способного замещаться
- неорганические;
- летучести: - летучие; - нелетучие; - по растворимости в воде: - растворимые - нерастворимые (кремниевая кислота) На рисунке представлен макет молекулы азотной кислоты (HNO3).
Слайд 12 Основания
Основания – группы сложных веществ, состоящих из атомов металлов и гидроксогрупп.
Основания
Основания
Основания – группы сложных веществ, состоящих из атомов металлов и гидроксогрупп. Основания

- растворимости в воде: - растворимые; - практически нерастворимые; - количеству гидроксогрупп; - однокислотные; - двукислотные; - трёхкислотные; - летучести: - летучие; - нелетучие; - стабильности: - стабильные; - нестабильные; - силе: - сильные (> 30%); - слабые (< 3%); - наличию кислорода: - кислородосодержащие; - бескислородные;
- типу соединения: - органические основания; - неорганические основания. Справа представлен образец основания -гидроксид алюминия ( Al(OH)3).
Слайд 13Периодическая система химических элементов Д.И.Менделеева
К середине XIX века были открыты 63 химических элемента. Учёными
Периодическая система химических элементов Д.И.Менделеева
К середине XIX века были открыты 63 химических элемента. Учёными

 Основы аналитической химии
Основы аналитической химии Исследование n-метилольных производных аллантоина методом тонкослойной хроматографии
Исследование n-метилольных производных аллантоина методом тонкослойной хроматографии Теория электролитической диссоциации. Ионные уравнения. Задания
Теория электролитической диссоциации. Ионные уравнения. Задания Электролитическая диссоциация
Электролитическая диссоциация Производство серной кислоты
Производство серной кислоты Соединения серы
Соединения серы Классы веществ
Классы веществ Презентация на тему Сложные эфиры
Презентация на тему Сложные эфиры  Материаловедение и технология конструкционных материалов
Материаловедение и технология конструкционных материалов Презентация по Химии "Химические элементы металлы и здоровье человека"
Презентация по Химии "Химические элементы металлы и здоровье человека"  Термодинамика и теплопередача. Влажный воздух
Термодинамика и теплопередача. Влажный воздух КАРБОНОВЫЕ КИСЛОТЫ Органическая химия 11 класс
КАРБОНОВЫЕ КИСЛОТЫ Органическая химия 11 класс Обсидиан
Обсидиан Природні сполуки алюмінію і методи одержання
Природні сполуки алюмінію і методи одержання Спирты
Спирты Термодинамика живого объекта. Основы биоэнергетики. Лекция 2
Термодинамика живого объекта. Основы биоэнергетики. Лекция 2 Многоэлектронные атомы
Многоэлектронные атомы 4. Диаграмма железо-углерод
4. Диаграмма железо-углерод Химическая связь
Химическая связь Учебник системы учебно-методических комплектов Алгоритм успеха
Учебник системы учебно-методических комплектов Алгоритм успеха Вспомогательные средства для стирки
Вспомогательные средства для стирки Азотные удобрения
Азотные удобрения Получение углекислого газа и изучение его свойств. Практическая работа
Получение углекислого газа и изучение его свойств. Практическая работа Эпоксидирование олефинов (халкон-процесс)
Эпоксидирование олефинов (халкон-процесс) Стратегия обучения решению задач по химии
Стратегия обучения решению задач по химии Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Соль. Добыча соли
Соль. Добыча соли Из опыта формирования и развития универсальных учебных действий при изучении темы Неметаллы
Из опыта формирования и развития универсальных учебных действий при изучении темы Неметаллы