Содержание
- 2. Изомерия органических соединений Изомерия – это явление, заключающееся в существовании соединений, одинаковых по количественному и качественному
- 3. 1.2.Изомерия положения 1.2.1 Изомерия положения кратной связи. Характерна для органических соединений содержащих кратные связи. Пример: C4H8
- 4. 2. Пространственная изомерия. Вещества, имеющие одинаковые состав и порядок связывания атомов в молекуле, но отличающихся друг
- 5. 2.2 Оптическая изомерия. Характерна для органических соединений, имеющих 4 разных заместителя у одного атома углерода, этот
- 6. Для оптических изомеров использут R,S- номенклатуру: Для названия изомеров нужно: 1.Определить старшинство заместителей (по порядковому номеру
- 7. 2.3 Конформационная изомерия – обусловлена вращением заместителей вокруг простых С – С связей (см. алканы). Конформационная
- 8. Химическое строение органических соединений Химическое строение –это порядок (последовательность) связей атомов в молекуле, а также характер
- 9. В 1915–1916 гг. В. Коссель и Г. Льюис предположили, что связи между атомами в органических молекулах
- 10. Формулы, показывающие число электронов в связях и неподеленные электронные пары (НЭП) на гетероатомах, получили название «формулы
- 11. Два способа образования валентной пары электронов и типы связей. В случае когда один атом предоставляет на
- 12. Частным случаем донорно-акцепторной связи является семиполярная связь. Она образуется при взаимодействии атомов, имеющих неподеленные электронные пары
- 13. ИОННАЯ СВЯЗЬ Ионная связь — химическая связь, обусловленная переносом валентных электронов с одного атома на другой
- 14. ВОДОРОДНАЯ СВЯЗЬ Для многих азот- и кислородсодержащих производных органических соединений характерно образование водородных связей, что существенно
- 15. КОВАЛЕНТНАЯ СВЯЗЬ Ковалентная связь является основным типом химической связи в органических соединениях. Она образуется между атомами,
- 16. В зависимости от числа общих электронных пар, возникающих между атомами при образовании связи, различают простые и
- 17. Гибридизация атомных орбиталей и форма органических молекул Атомной орбиталью (АО) называют область пространства, внутри которой вероятность
- 18. s-Орбиталь всегда обладает сферической симметрией (форма шара) относительно ядра атома: волновая функция s-орбитали положительна во всей
- 19. ОСНОВНЫЕ ПОЛОЖЕНИЯ МЕТОДА ВАЛЕНТНЫХ СВЯЗЕЙ (ВС) 1. Химическая связь (ХС) между атомами образуется в результате обобществления
- 20. Гибридизация АО. Типы гибридизации. Теория отталкивания валентных электронных пар (ОВЭП). Эта теория устанавливает зависимость между геометрией
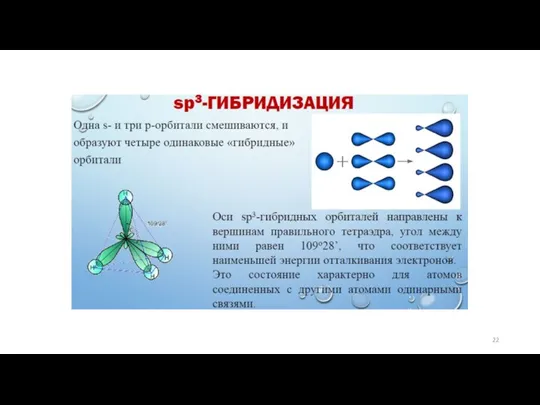
- 21. Типы гибридизации. Для атома углерода характерны три типа гибридизации с участием s- и р-орбиталей: sр3-, sр2-
- 25. Скачать презентацию
Слайд 2Изомерия органических соединений
Изомерия – это явление, заключающееся в существовании соединений, одинаковых
Изомерия органических соединений
Изомерия – это явление, заключающееся в существовании соединений, одинаковых
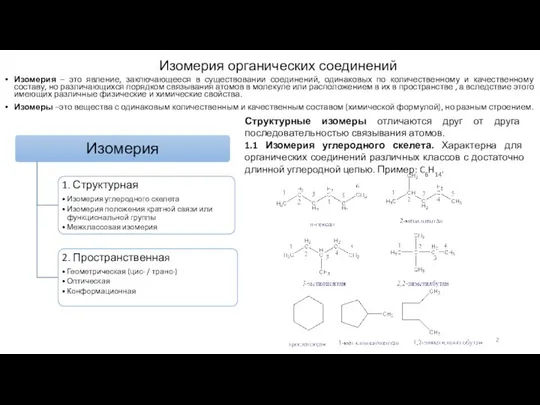
Изомеры –это вещества с одинаковым количественным и качественным составом (химической формулой), но разным строением.
Структурные изомеры отличаются друг от друга последовательностью связывания атомов.
1.1 Изомерия углеродного скелета. Характерна для органических соединений различных классов с достаточно длинной углеродной цепью. Пример: C6H14.
Слайд 31.2.Изомерия положения
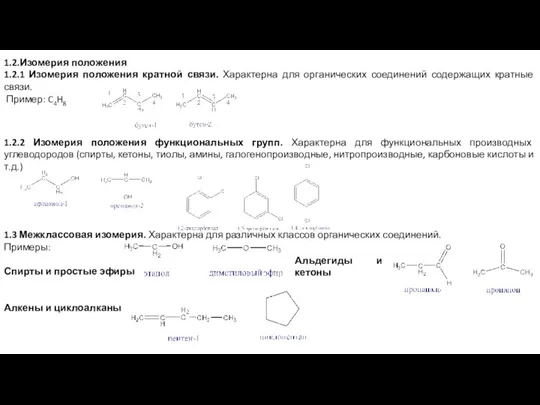
1.2.1 Изомерия положения кратной связи. Характерна для органических соединений содержащих кратные
1.2.Изомерия положения
1.2.1 Изомерия положения кратной связи. Характерна для органических соединений содержащих кратные
Пример: C4H8
1.2.2 Изомерия положения функциональных групп. Характерна для функциональных производных углеводородов (спирты, кетоны, тиолы, амины, галогенопроизводные, нитропроизводные, карбоновые кислоты и т.д.)
1.3 Межклассовая изомерия. Характерна для различных классов органических соединений.
Примеры:
Спирты и простые эфиры
Алкены и циклоалканы
Альдегиды и кетоны
Слайд 42. Пространственная изомерия.
Вещества, имеющие одинаковые состав и порядок связывания атомов в
2. Пространственная изомерия.
Вещества, имеющие одинаковые состав и порядок связывания атомов в

2.1 Геометрическая изомерия. Геометрическими изомерами называют вещества, имеющие одинаковый состав и последовательность связывания атомов в молекулах, но разное расположение заместителей в пространстве относительно плоскости двойной связи или плоскости цикла.
Для обозначения конфигурации геометрических изомеров используют цис-транс- и E,Z-систему. Цис-/транс-система обозначений конфигурации имеет ограниченное применение. Ее можно использовать только тогда, когда связанные двойной связью углеродные атомы имеют одинаковые заместители.
Если одинаковые заместители расположены по одну сторону от плоскости двойной связи, конфигурацию обозначают цис-, если по разные стороны — транс-:
Когда углеродные атомы, образующие двойную связь, имеют все разные заместители, как, например, в 1-бром-1-хлорпропене, применение цис-транс- системы становится невозможным. В таких случаях используют Е,Z-систему обозначений. Старшинство заместителей определяется по порядковому номеру элемента из табл. Периодической системы Д.И. Менделеева.
Если при этом старшие заместители из каждой пары расположены по одну сторону от плоскости двойной связи, конфигурацию обозначают буквой Z (от нем. Zusammen — вместе), если по разные стороны — буквой Е (от нем. Еntgegen — напротив).
Слайд 52.2 Оптическая изомерия. Характерна для органических соединений, имеющих 4 разных заместителя у
2.2 Оптическая изомерия. Характерна для органических соединений, имеющих 4 разных заместителя у

При этом появляется возможность наличия 2-х изомеров
с разными пространственным расположением заместителей,
относящихся к друг другу как предмет и его зеркальное отражение.
Такие оптические изомеры называются энантиомерами.
Энантиомеры отличаюся друг от друга только:
1)Взаимодействием с плоскополяризованным лучом света (бывают правовращающие и левовращающие D(+) и L(-))
2)Взаимодействием с хиральными реагентами
3)Биологической активностью
Слайд 6Для оптических изомеров использут R,S- номенклатуру:
Для названия изомеров нужно:
1.Определить старшинство заместителей (по
Для оптических изомеров использут R,S- номенклатуру:
Для названия изомеров нужно:
1.Определить старшинство заместителей (по

2. Расположить заместители так, чтобы младший заместитель был максимально удалён;
3. Если переход от старшего заместителя к младшему происходит по часовой стрелке, то это R-изомер; если против часовой стрелки – то это S-изомер.
Слайд 72.3 Конформационная изомерия – обусловлена вращением заместителей вокруг простых С – С
2.3 Конформационная изомерия – обусловлена вращением заместителей вокруг простых С – С

Конформационная изомерия обусловлена вращением отдельных фрагментов молекулы вокруг одинарных связей. В результате вращения молекула может принимать различные пространственные формы, называемые конформациями.
Молекула этана вследствие вращения вокруг углерод-углеродной связи может принимать бесконечное множество конформаций, каждая из которых характеризуется определенным значением потенциальной энергии. Две крайние конформации называют заслоненной и заторможенной.
Для изображения конформаций на плоскости используют перспективные формулы и проекционные формулы Ньюмена.
Слайд 8Химическое строение органических соединений
Химическое строение –это порядок (последовательность) связей атомов в молекуле,
Химическое строение органических соединений
Химическое строение –это порядок (последовательность) связей атомов в молекуле,

Химическое строение органических молекул, т.е. структура молекул графически отражается формулами строения (структурными формулами). Структурная формула –это изображение последовательности связи атомов в молекуле.
В отличие от неорганических соединений, для которых характерны ионные связи, органическим соединениям присущи ковалентные связи. Природа ковалентной связи в настоящее время интерпретируется в рамках двух подходов. В основе первого подхода лежат правило октетов Г. Льюиса (см следующий слайд!) и представления об электронных эффектах. Второй подход основан на квантово-химическом представлении природы ковалентной связи.
Согласно электронной теории, химическая связь рассматривается как результат взаимодействия внешних электронных оболочек (валентных электронов) атомов.
Образование валентной электронной пары может протекать по двум механизмам- обменному и донорно-акцепторному.
Учитывая химическую инертность благородных газов, их внешние электронные оболочки (для гелия — двух-электронная, для неона, аргона и т. п.— восьми-электронная) считают наиболее устойчивыми к взаимодействию. Стремление атомов других элементов связываться друг с другом обусловлено неустойчивостью их валентных оболочек. Поэтому каждый атом, образуя химическую связь, принимает, отдает или обобществляет валентные электроны таким образом, чтобы его внешняя электронная оболочка соответствовала конфигурации инертных газов. Такой принцип заполнения валентных оболочек получил название «октетное правило», или «правило октета».
Слайд 9В 1915–1916 гг. В. Коссель и Г. Льюис предположили, что связи между
В 1915–1916 гг. В. Коссель и Г. Льюис предположили, что связи между

Льюис впервые сформулировал правило октетов: каждый атом стремится к заполнению вокруг себя устойчивой оболочки инертного газа.
Для атома водорода такой оболочкой является двухэлектронная оболочка гелия; для атомов 2-го периода — восьмиэлектронная оболочка неона. Каждый электрон в формуле Льюиса изображают точкой.
Правило дублетов – октетов Льюиса
В образовании химической связи принимают участие
только валентные электроны – электроны внешних слоев атомов!
Слайд 10Формулы, показывающие число электронов в связях и неподеленные электронные пары (НЭП) на
Формулы, показывающие число электронов в связях и неподеленные электронные пары (НЭП) на

Формулы Льюиса показывают, что кратные связи содержат четыре (двойная связь) или шесть (тройная связь) электронов.
Слайд 11Два способа образования валентной пары электронов и типы связей.
В случае когда один
Два способа образования валентной пары электронов и типы связей.
В случае когда один

При этом атом, поставляющий пару электронов в общее пользование, называют донором, а атом, принимающий электроны,— акцептором. Донор должен иметь пару неподеленных электронов. Акцептором может быть протон или другой атом, у которого не хватает до образования октета двух электронов. По донорно-акцепторному механизму, например, протекает образование иона аммония, гидроксония и др.:
Образуется за счет двух электронов, предоставляемых одним из атомов.
Слайд 12Частным случаем донорно-акцепторной связи является семиполярная связь.
Она образуется при взаимодействии атомов, имеющих
Частным случаем донорно-акцепторной связи является семиполярная связь.
Она образуется при взаимодействии атомов, имеющих

В итоге эти два атома оказываются связанными двояко: ковалентной связью и ионной. Ниже приведены примеры образования семиполярной связи в молекулах триметиламин-N-оксида и нитробензола:
Во втором случае каждый атом отдает на образование валентной пары по одному неспаренному электрону (обменный механизм образования связи). В зависимости от относительной электроотрицательности образующих связь элементов при этом получаются разные типы связей: неполярная ковалентная, ковалентная с разной степенью полярности и ионная. Четкой границы между этими типами связей не существует.
Слайд 13ИОННАЯ СВЯЗЬ
Ионная связь — химическая связь, обусловленная переносом валентных электронов с одного
Ионная связь — химическая связь, обусловленная переносом валентных электронов с одного

Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО>1,7поПолингу) ,то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов
A•+•B→A+[:B-]
В металлорганических соединениях наблюдается связь близкая к ионной.
Слайд 14ВОДОРОДНАЯ СВЯЗЬ
Для многих азот- и кислородсодержащих производных органических соединений характерно образование водородных
Для многих азот- и кислородсодержащих производных органических соединений характерно образование водородных

Водородная связь –химическая связь между положительно поляризованными атомами водорода одной молекулы и атомами сильно электроотрицательных элементов другой или той же молекулы.
Водородная связь – особый вид химической связи типа X–H...Y, в которой центральный атом водорода, соединенный ковалентной связью с электроотрицательным атомом X (O, N, S), образует дополнительную связь с атомом Y (O, N, S), имеющим неподеленную пару электронов. Природа связи достаточно сложная и включает: электростатическое взаимодействие за счёт частичных зарядов атомов Н и Y, донорно-акцепторное взаимодействие Н с неподелённой парой атома Y, другие взаимодействия. (встречается в спиртах, аминах, карбоновых кислотах).
Если водородная связь образуется между группами одной и той же молекулы, она называется внутримолекулярной (например, в белках, в молекуле ДНК).
Если водородная связь образуется между разными молекулами, она называется межмолекулярной (например, между молекулами воды, низших спиртов).
Слайд 15КОВАЛЕНТНАЯ СВЯЗЬ
Ковалентная связь является основным типом химической связи в органических соединениях. Она
КОВАЛЕНТНАЯ СВЯЗЬ
Ковалентная связь является основным типом химической связи в органических соединениях. Она

Полярную ковалентную связь изображают в виде прямой стрелки, направленной к более электроотрицательному атому. Буквой δ (греч. «дельта») условно обозначают дробные (частичные) заряды на атомах. Символ δ+ отражает пониженную, а δ– — повышенную
электронную плотность.
Слайд 16В зависимости от числа общих электронных пар, возникающих между атомами при образовании
В зависимости от числа общих электронных пар, возникающих между атомами при образовании
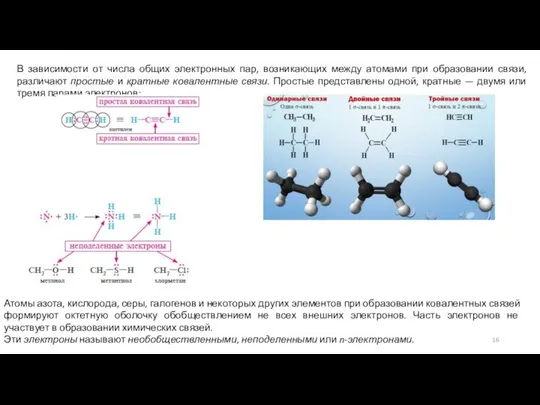
Атомы азота, кислорода, серы, галогенов и некоторых других элементов при образовании ковалентных связей формируют октетную оболочку обобществлением не всех внешних электронов. Часть электронов не участвует в образовании химических связей.
Эти электроны называют необобществленными, неподеленными или n-электронами.
Слайд 17Гибридизация атомных орбиталей и форма органических молекул
Атомной орбиталью (АО) называют область пространства,
Гибридизация атомных орбиталей и форма органических молекул
Атомной орбиталью (АО) называют область пространства,

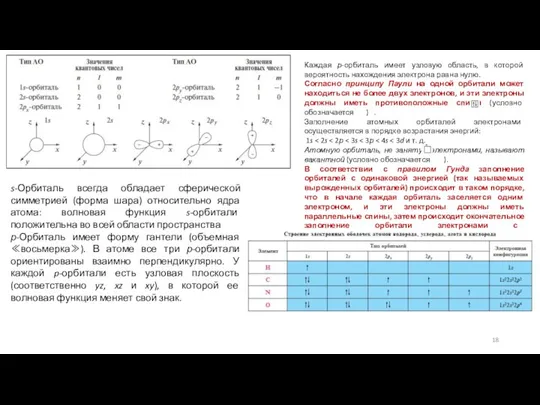
Согласно квантово-механическим представлениям, электроны в атомах находятся на атомных орбиталях. В физическом понимании каждая АО представляет собой волновую функцию. Она описывается собственным набором квантовых чисел и для атома водорода может быть выражена математической функцией. Атом каждого элемента обладает орбиталями лишь определенного типа и числа. Ниже даны условные графические представления орбиталей атомов элементов 2-го периода и наборы квантовых чисел, описывающих эти орбитали.
Главное квантовое число n определяет размер и энергию АО; оно может принимать целочисленные значения, а его максимальное значение для данного элемента определяется номером периода.
По боч ное (ази му таль ное) кван то вое чис ло l определяет форму АО:
l = 0, 1, ..., (n – 1).
Магнитное квантовое число m определяет пространственную ориентацию АО: m = 0, ±1, ..., ±l.
Геометрические формы
s-, р-, d- атомных орбиталей.
Слайд 18s-Орбиталь всегда обладает сферической симметрией (форма шара) относительно ядра атома: волновая функция
s-Орбиталь всегда обладает сферической симметрией (форма шара) относительно ядра атома: волновая функция
р-Орбиталь имеет форму гантели (объемная ≪восьмерка≫). В атоме все три р-орбитали ориентированы взаимно перпендикулярно. У каждой p-орбитали есть узловая плоскость (соответственно yz, xz и xy), в которой ее волновая функция меняет свой знак.
Каждая р-орбиталь имеет узловую область, в которой вероятность нахождения электрона равна нулю.
Согласно принципу Паули на одной орбитали может находиться не более двух электронов, и эти электроны должны иметь противоположные спины (условно обозначается ) .
Заполнение атомных орбиталей электронами осуществляется в порядке возрастания энергий:
1s < 2s < 2р < 3s < 3р < 4s < 3d и т. д.
Атомную орбиталь, не занятую электронами, называют вакантной (условно обозначается ).
В соответствии с правилом Гунда заполнение орбиталей с одинаковой энергией (так называемых вырожденных орбиталей) происходит в таком порядке, что в начале каждая орбиталь заселяется одним электроном, и эти электроны должны иметь параллельные спины, затем происходит окончательное заполнение орбитали электронами с антипараллельными спинами.
Слайд 19ОСНОВНЫЕ ПОЛОЖЕНИЯ МЕТОДА ВАЛЕНТНЫХ СВЯЗЕЙ (ВС)
1. Химическая связь (ХС) между атомами образуется
ОСНОВНЫЕ ПОЛОЖЕНИЯ МЕТОДА ВАЛЕНТНЫХ СВЯЗЕЙ (ВС)
1. Химическая связь (ХС) между атомами образуется

2. Общие электронные пары образуют лишь неспаренные электроны с антипараллельными спинами.
3. При образовании ХС происходит частичное перекрывание атомных орбиталей (АО), что приводит к увеличению электронной плотности в межъядерном пространстве.
4. Химическая связь тем прочнее, чем в большей степени перекрываются взаимодействующие АО.
5. В пространстве ХС располагается в том направлении, в котором возможность перекрывания АО наибольшая.
6. Связь, образованная перекрыванием АО по линии, соединяющей центры атомов, называется σ-связью, а по обе стороны от линии– π-связью.
7. Если молекула образуется путем перекрывания двух АО, связь называется одинарной, если более двух АО–кратной. Одинарная связь представлена всегда σ-связью, а кратные связи включают σ- и π-связи.
8. Общая электронная пара соответствует единице химической связи.
ОСНОВНЫЕ ПОЛОЖЕНИЯ МЕТОДА МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ(ММО)
1. При образовании молекулы по ММО изменяют свое состояние не только валентные электроны, а все электроны соединяемых атомов. Они переходят с АО (одно ядро, одноцентровые) на более сложные многоцентровые–МО.
2. МО – это объем пространства в поле нескольких ядер, где вероятность нахождения электронов составляет 90-95%.
3. Для получения МО используют метод линейной комбинации атомных орбиталей МЛКАО. Из двух АО разных атомов образуется две МО:
4. Связывающая, которая характеризуется меньшим запасом энергии по сравнению с запасом энергии АО;
5. Разрыхляющая–с большим запасом энергии.
6. Число МО равно сумме АО соединяемых атомов.
7. Распределение электронов на МО молекулы подчиняется тем же правилам, что и по АО в атоме.
8. Химическая связь в ММО характеризуется энергией связи и кратностью.
Ковалентная связь. Для описания ковалентной связи с позиций квантовой механики используют метод молекулярных орбиталей (МО) и валентных связей (ВС). Оба метода представляют собой математические приемы приближенного
решения уравнения Шрёдингера применительно к молекуле.
Слайд 20Гибридизация АО. Типы гибридизации.
Теория отталкивания валентных электронных пар (ОВЭП). Эта теория
Гибридизация АО. Типы гибридизации.
Теория отталкивания валентных электронных пар (ОВЭП). Эта теория

Гибридизация — смешение валентных (внешних) орбиталей и выравнивание их по форме и энергии.
Основные положения теории:
Гибридные орбитали обеспечивают максимальное перекрывание при образовании σ-связи (сигма-).
Число гибридных орбиталей равно числу АО.
Гибридизуются близкие по энергии АО.
В гибридизации участвуют АО, имеющие общие признаки симметрии.
Слайд 21Типы гибридизации.
Для атома углерода характерны три типа гибридизации с участием s- и
Типы гибридизации.
Для атома углерода характерны три типа гибридизации с участием s- и

Этот вид гибридизации происходит, когда смешиваются одна s-орбиталь и три p-орбитали. В результате происходит образование четырех полноценных sp3-орбиталей. Эти орбитали направлены к вершине тетраэдра и располагаются друг к другу под углом 109,28 градусов.
4 sp3 гибридные орбитали
1s + 3p

 Электрический ток в металлах
Электрический ток в металлах Электролитическая диссоциация. Устойчивость комплексных соединений
Электролитическая диссоциация. Устойчивость комплексных соединений Строение гклюкозы
Строение гклюкозы Ювелирные камни
Ювелирные камни Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс
Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски
ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски Целестин
Целестин Гидролиз солей
Гидролиз солей 1. Классификация материалов
1. Классификация материалов Сероводород, сульфиды
Сероводород, сульфиды Реакция полимеризации
Реакция полимеризации Электролиз солей
Электролиз солей Определение содержание фосфатов в воде фотометрическим методом
Определение содержание фосфатов в воде фотометрическим методом Коррозия металлов, сплавов
Коррозия металлов, сплавов Календарь юного химика. 2013-2014 учебный год
Календарь юного химика. 2013-2014 учебный год Валентность. Порядок действий при составлении химической формулы
Валентность. Порядок действий при составлении химической формулы Амины. Номенклатура аминов
Амины. Номенклатура аминов Основи прийняття рішень, щодо захисту населення під час різних фаз радіаційної аварії. Критерії для прийняття рішень
Основи прийняття рішень, щодо захисту населення під час різних фаз радіаційної аварії. Критерії для прийняття рішень Строение и химический состав костей, рост костей
Строение и химический состав костей, рост костей Понятие о спиртах
Понятие о спиртах Оксиды. 8 класс
Оксиды. 8 класс Технология производства и свойства химических волокон и тканей из них
Технология производства и свойства химических волокон и тканей из них Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева Перманганатометрия и комплексонометрия
Перманганатометрия и комплексонометрия Опасность вещества поливинилхлорида
Опасность вещества поливинилхлорида тэд — без анимации(1)
тэд — без анимации(1) Тема_6б_химическая_кинетика
Тема_6б_химическая_кинетика ad8c00e7ea114b35a6fc29426ea31646 (1)
ad8c00e7ea114b35a6fc29426ea31646 (1)