Слайд 7Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту

и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливоБлагодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химииБлагодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицинеБлагодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующихБлагодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора (ускорителя химических реакций). В медицине растворы пероксида водорода применяются как антисептическое средствоБлагодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора (ускорителя химических реакций). В медицине растворы пероксида водорода применяются как антисептическое средство. При контакте с поврежденной кожей и слизистыми пероксид водорода под влиянием фермента каталазы распадается с выделением кислорода, что способствует сворачиванию крови и создает неблагоприятные условия для развития микроорганизмов (противомикробное средство).











 Движение электрона в атоме
Движение электрона в атоме Окситоцин. Сила любви и биология
Окситоцин. Сила любви и биология Классификация сложных неорганических веществ. Оксиды
Классификация сложных неорганических веществ. Оксиды Кристаллическая структура вещества. Вывод формульных единиц по отношению масс элементов и по массовым долям элементов. (Урок №6)
Кристаллическая структура вещества. Вывод формульных единиц по отношению масс элементов и по массовым долям элементов. (Урок №6)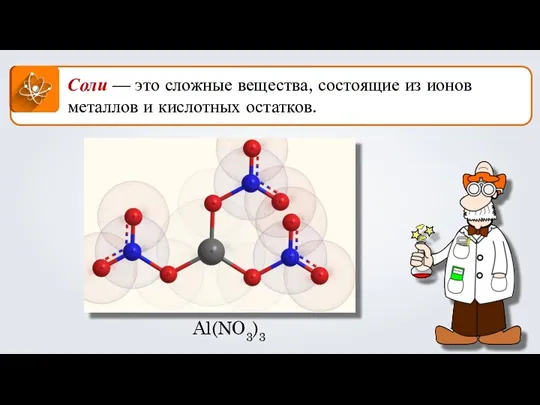 Соли. Формула соли
Соли. Формула соли Тяжелосредные гидроциклоны
Тяжелосредные гидроциклоны Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса
Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса Итоговая консультация. Формульный диктант
Итоговая консультация. Формульный диктант Составление ионных уравнений
Составление ионных уравнений Кристаллы. Формирование кристаллов
Кристаллы. Формирование кристаллов Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП
Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП Общая характеристика металлов
Общая характеристика металлов Строение атома. Планетарная модель атома Резерфорда
Строение атома. Планетарная модель атома Резерфорда Жиры. Строение жиров
Жиры. Строение жиров Презентация на тему Элементы таблицы Менделеева
Презентация на тему Элементы таблицы Менделеева  Бытовая химия
Бытовая химия Амфотерные гидроксиды
Амфотерные гидроксиды Присоединение диарилфосфинитов к а-имидоакрилатам
Присоединение диарилфосфинитов к а-имидоакрилатам 9_OSNOVY_KOLANALIZA
9_OSNOVY_KOLANALIZA Полупроводниковые твердые растворы
Полупроводниковые твердые растворы Презентация на тему Применение солей в быту
Презентация на тему Применение солей в быту  Общая характеристика нефти и газа
Общая характеристика нефти и газа Положение металлов в периодической системе химических элементов
Положение металлов в периодической системе химических элементов Галогеноалканы: получение, свойства и применение
Галогеноалканы: получение, свойства и применение Основные обозначения. Основные понятия. Практическая работа № 2
Основные обозначения. Основные понятия. Практическая работа № 2 Получение волокон на основе сверхвысокомолекулярного полиэтилена
Получение волокон на основе сверхвысокомолекулярного полиэтилена Творческий отчет кружка Юные химики
Творческий отчет кружка Юные химики Неидеальные растворы
Неидеальные растворы