Содержание
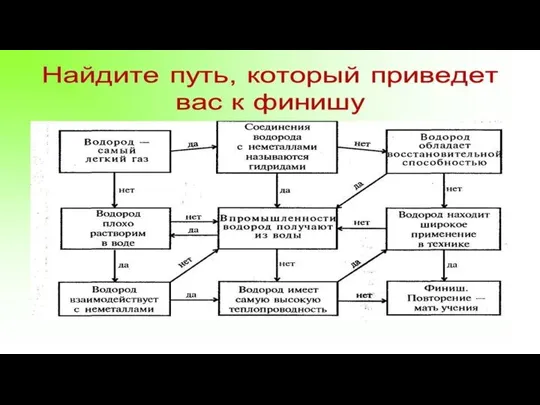
- 2. Вопросы к Д/З 1. Дайте характеристику и положение в таблице элемента водорода и его простого вещества?
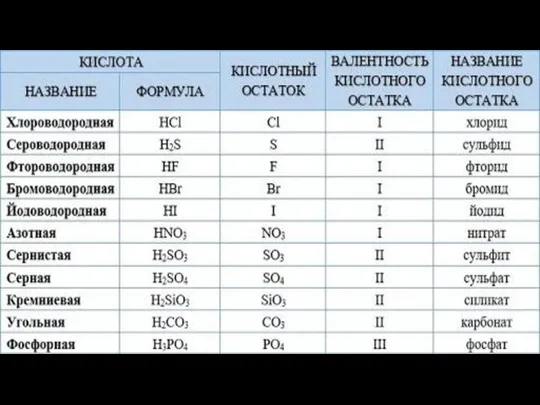
- 6. Лимонная кислота Яблочная кислота Щавелевая кислота Муравьиная кислота Уксусная кислота Молочная кислота
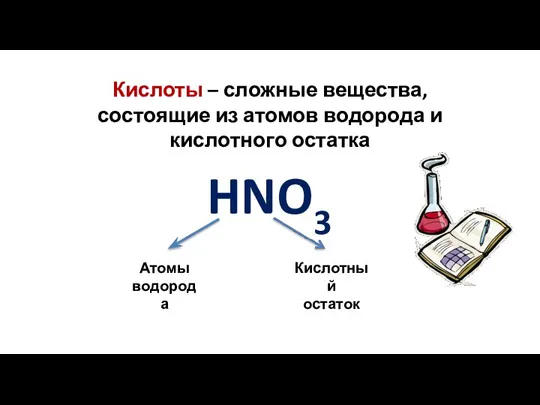
- 7. Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка HNO3 Атомы водорода Кислотный остаток
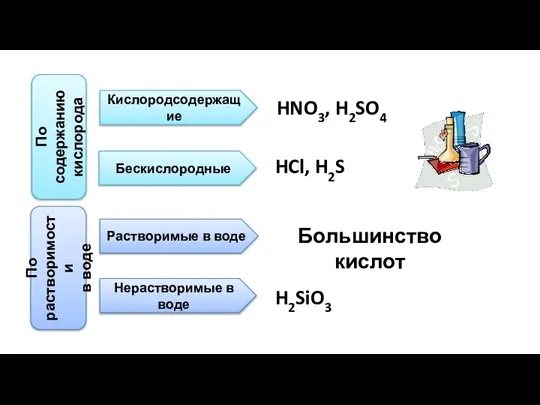
- 9. По содержанию кислорода Кислородсодержащие Бескислородные HNO3, H2SO4 HCl, H2S По растворимости в воде Растворимые в воде
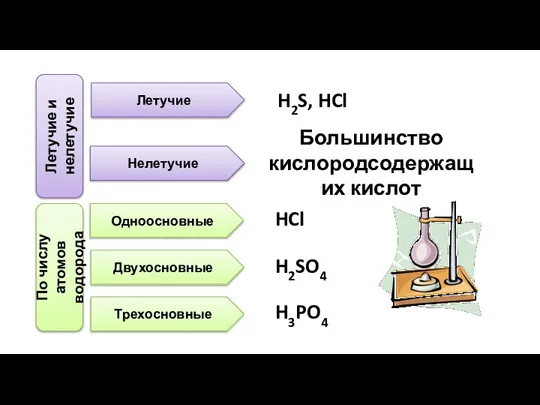
- 10. Летучие и нелетучие Летучие H2S, HCl Нелетучие Большинство кислородсодержащих кислот По числу атомов водорода Одноосновные Двухосновные
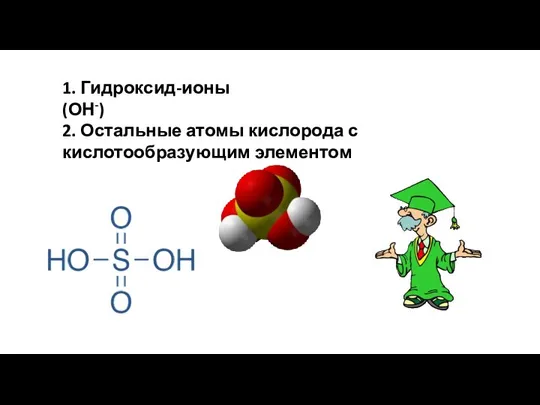
- 11. 1. Гидроксид-ионы (ОН-) 2. Остальные атомы кислорода с кислотообразующим элементом
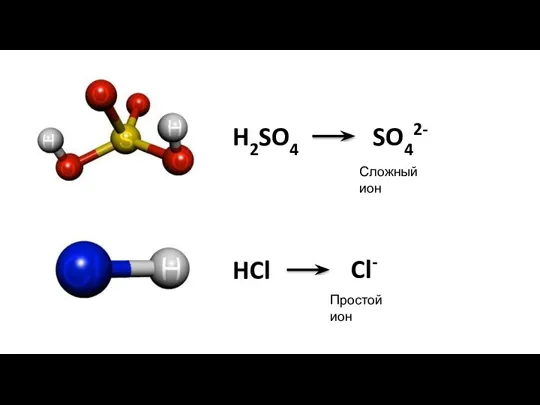
- 12. H2SO4 SO42- Сложный ион HCl Cl- Простой ион
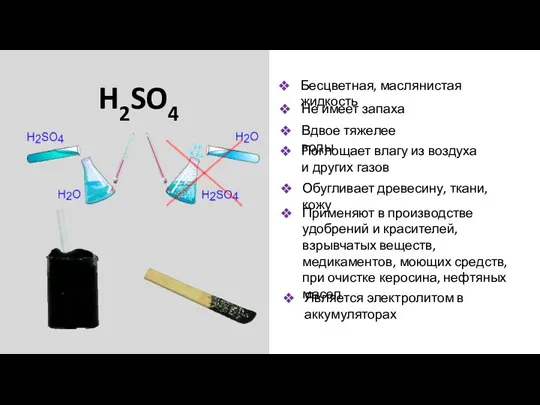
- 13. H2SO4 Бесцветная, маслянистая жидкость Не имеет запаха Вдвое тяжелее воды Поглощает влагу из воздуха и других
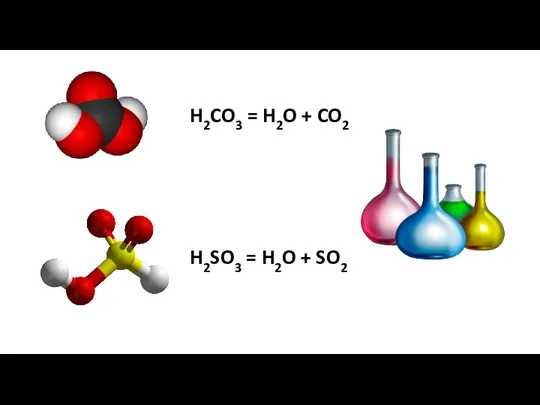
- 14. H2CO3 = H2O + CO2 H2SO3 = H2O + SO2
- 15. Окраска индикаторов в кислотах
- 16. Универсальная индикаторная бумага Шкала рН Кислая среда Щелочная среда Нейтральная среда рН = 7 – среда
- 17. Определение степени окисления элементов в кислоте H2S (+1) · 2 + x + (-2) · 3
- 19. Скачать презентацию







 Валентность химических элементов. Определение валентности элементов по формулам их соединений
Валентность химических элементов. Определение валентности элементов по формулам их соединений Получение металлов
Получение металлов Каучук и резиновые материалы
Каучук и резиновые материалы Удивительное рядом
Удивительное рядом Ацилирование. Лекция 4
Ацилирование. Лекция 4 Получение и применение кислорода. Круговорот кислорода в природе
Получение и применение кислорода. Круговорот кислорода в природе Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона
Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона Glin
Glin Наполнители для пластмасс
Наполнители для пластмасс Фенолы
Фенолы Вода… Химические названия
Вода… Химические названия Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы
Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы Классификация органических веществ
Классификация органических веществ Химия и география. Викторина
Химия и география. Викторина Metals Properties and compounds
Metals Properties and compounds Сухая вода помогла измерить поляризацию ковалентных связей
Сухая вода помогла измерить поляризацию ковалентных связей Химико-металлургические методы
Химико-металлургические методы Атомы. Нахождение в природе
Атомы. Нахождение в природе Теоретические основы процессов получения и переработки полимерных материалов
Теоретические основы процессов получения и переработки полимерных материалов Устный журнал из истории развития химии
Устный журнал из истории развития химии Опасная бытовая химия!
Опасная бытовая химия! способы разделения смесей
способы разделения смесей Презентация по химии. Спирты, их свойства и применение.
Презентация по химии. Спирты, их свойства и применение. Классификация НПВС (по химической структуре активности)
Классификация НПВС (по химической структуре активности) Физико-химические основы получения лекарственных препаратов
Физико-химические основы получения лекарственных препаратов валентность (1)
валентность (1) Исследование коррозии и создание антикоррозийного состава
Исследование коррозии и создание антикоррозийного состава Химические системы. Химическая термодинамика. Химическое равновесие
Химические системы. Химическая термодинамика. Химическое равновесие