Содержание
- 2. I. Строение молекул углекислого газа Молекулы углекислого газа всегда состоят из двух атомов кислорода и одного
- 3. II.Открытие углекислого газа. Углекислый газ был первым между всеми другими газами противопоставлен воздуху под названием «дикий
- 4. III. Физические свойства Оксид углерода (IV) – углекислый газ, газ без цвета и запаха, тяжелее воздуха,
- 5. IV. Получение углекислого газа Получение углекислого газа в промышленности: Оксид углерода 2 горит в кислороде и
- 6. V. Распознание углекислого газа Для обнаружения диоксида углерода можно провести следующую реакцию: СаСО3+2HCl=CaCl2+CO2+H2O Твёрдое вещество или
- 7. VI. Применение углекислого газа Углекислый газ применяют во многих отраслях. Например: 1.Химическая отрасль; 2.Фармацевтика; 3.Пищевая отрасль;
- 8. VII. Нахождение в природе Содержание углекислого газа в атмосфере относительно небольшое, около 0,03% (по объему). Углекислый
- 10. Скачать презентацию
Слайд 2I. Строение молекул углекислого газа
Молекулы углекислого газа всегда состоят из двух атомов кислорода
I. Строение молекул углекислого газа
Молекулы углекислого газа всегда состоят из двух атомов кислорода
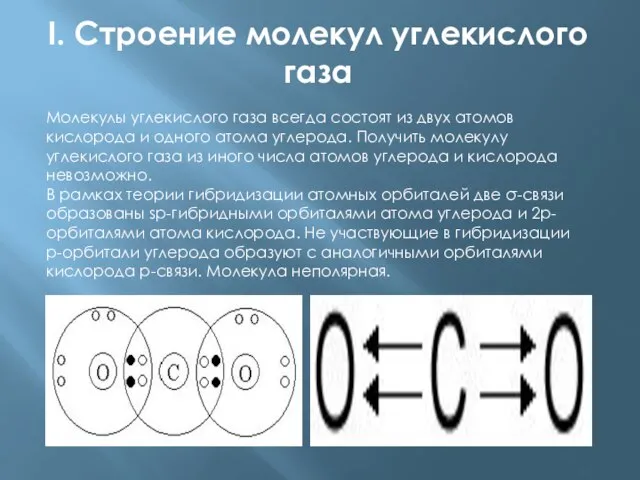
и одного атома углерода. Получить молекулу углекислого газа из иного числа атомов углерода и кислорода невозможно.
В рамках теории гибридизации атомных орбиталей две σ-связи образованы sp-гибридными орбиталями атома углерода и 2р-орбиталями атома кислорода. Не участвующие в гибридизации р-орбитали углерода образуют с аналогичными орбиталями кислорода p-связи. Молекула неполярная.
В рамках теории гибридизации атомных орбиталей две σ-связи образованы sp-гибридными орбиталями атома углерода и 2р-орбиталями атома кислорода. Не участвующие в гибридизации р-орбитали углерода образуют с аналогичными орбиталями кислорода p-связи. Молекула неполярная.
Слайд 3II.Открытие углекислого газа.
Углекислый газ был первым между всеми другими газами противопоставлен воздуху
II.Открытие углекислого газа.
Углекислый газ был первым между всеми другими газами противопоставлен воздуху

под названием «дикий газ» алхимиком XVI века Вант Гельмонтом.
Открытием СО2 было положено начало новой отрасли химии – пневматохимии (химии газов).
Шотландский химик Джозеф Блэк (1728–1799) в 1754 году установил, что известковый минерал мрамор (карбонат кальция) при нагревании разлагается с выделением газа и образует негашеную известь (оксид кальция):
CaCO3CaO + CO2
Выделяющийся газ можно было вновь соединить с оксидом кальция и вновь получить карбонат кальция:
CaO + CO2CaCO3
Этот газ был идентичен открытому Ван Гельмонтом «дикому газу», но Блэк дал ему новое название – «связанный воздух» – так как этот газ можно было связать и вновь получить твердую субстанцию – карбонат кальция.
Несколько лет спустя Кавендиш обнаружил еще два характерных физических свойства углекислого газа – его высокую плотность и значительную растворимость в воде.
Открытием СО2 было положено начало новой отрасли химии – пневматохимии (химии газов).
Шотландский химик Джозеф Блэк (1728–1799) в 1754 году установил, что известковый минерал мрамор (карбонат кальция) при нагревании разлагается с выделением газа и образует негашеную известь (оксид кальция):
CaCO3CaO + CO2
Выделяющийся газ можно было вновь соединить с оксидом кальция и вновь получить карбонат кальция:
CaO + CO2CaCO3
Этот газ был идентичен открытому Ван Гельмонтом «дикому газу», но Блэк дал ему новое название – «связанный воздух» – так как этот газ можно было связать и вновь получить твердую субстанцию – карбонат кальция.
Несколько лет спустя Кавендиш обнаружил еще два характерных физических свойства углекислого газа – его высокую плотность и значительную растворимость в воде.
Слайд 4III. Физические свойства
Оксид углерода (IV) – углекислый газ, газ без цвета и
III. Физические свойства
Оксид углерода (IV) – углекислый газ, газ без цвета и

запаха, тяжелее воздуха, растворим в воде, при сильном охлаждении кристаллизуется в виде белой снегообразной массы – «сухого льда» . При атмосферном давлении он не плавится, а испаряется, температура сублимации -78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Мало растворим в воде (1 объем углекислого газа в одном объеме воды при 15 °С) .
Слайд 5IV. Получение углекислого газа
Получение углекислого газа в промышленности:
Оксид углерода 2
IV. Получение углекислого газа
Получение углекислого газа в промышленности:
Оксид углерода 2

горит в кислороде и на воздухе с выделением большого количества теплоты:
2СО+О2=2СО2
Таким же способом углекислый газ можно получать и в лаборатории.
Оксид углерода 2 является сильным восстановителем, поэтому в промышленности его используют для восстановления железных руд:
Fe2O3+3CO=2Fe+3CO2
В промышленности оксид углерода 4 получают при сжигании угля или при прокаливании известняка:
СаСО3=СаО+СО2
Получение углекислого газа в лаборатории:
В лаборатории СО2 получают действием кислот на соли угольной кислоты Н2СО3:
Na2CO3+H2SO4=Na2SO4+CO2+H2O
При действии кислот на карбонаты и их растворы происходит выделение диоксида углерода, вызывающего вспенивание раствора:
СаСО3+НCl=CaCl2+CO2+H2O
2СО+О2=2СО2
Таким же способом углекислый газ можно получать и в лаборатории.
Оксид углерода 2 является сильным восстановителем, поэтому в промышленности его используют для восстановления железных руд:
Fe2O3+3CO=2Fe+3CO2
В промышленности оксид углерода 4 получают при сжигании угля или при прокаливании известняка:
СаСО3=СаО+СО2
Получение углекислого газа в лаборатории:
В лаборатории СО2 получают действием кислот на соли угольной кислоты Н2СО3:
Na2CO3+H2SO4=Na2SO4+CO2+H2O
При действии кислот на карбонаты и их растворы происходит выделение диоксида углерода, вызывающего вспенивание раствора:
СаСО3+НCl=CaCl2+CO2+H2O
Слайд 6V. Распознание углекислого газа
Для обнаружения диоксида углерода можно провести следующую реакцию:
СаСО3+2HCl=CaCl2+CO2+H2O
V. Распознание углекислого газа
Для обнаружения диоксида углерода можно провести следующую реакцию:
СаСО3+2HCl=CaCl2+CO2+H2O
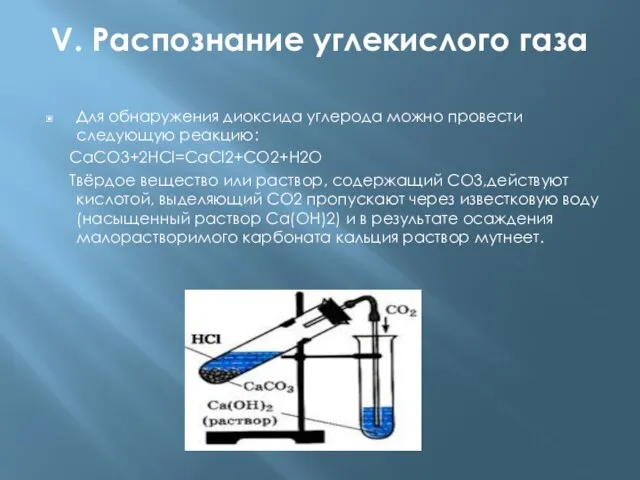
Твёрдое вещество или раствор, содержащий СО3,действуют кислотой, выделяющий СО2 пропускают через известковую воду (насыщенный раствор Са(ОН)2) и в результате осаждения малорастворимого карбоната кальция раствор мутнеет.
Слайд 7VI. Применение углекислого газа
Углекислый газ применяют во многих отраслях.
Например:
1.Химическая
VI. Применение углекислого газа
Углекислый газ применяют во многих отраслях.
Например:
1.Химическая

отрасль;
2.Фармацевтика;
3.Пищевая отрасль;
4.Медицина;
5.Металлургическая отрасль;
6.Лабораторные исследования и анализ;
7.Целлюлозно-бумажная отрасль;
8.Электроника;
9.Охрана окружающей среды.
2.Фармацевтика;
3.Пищевая отрасль;
4.Медицина;
5.Металлургическая отрасль;
6.Лабораторные исследования и анализ;
7.Целлюлозно-бумажная отрасль;
8.Электроника;
9.Охрана окружающей среды.
Слайд 8 VII. Нахождение в природе
Содержание углекислого газа в атмосфере относительно небольшое, около
VII. Нахождение в природе
Содержание углекислого газа в атмосфере относительно небольшое, около

0,03% (по объему). Углекислый газ, сосредоточенный в атмосфере, имеет массу 2200 биллионов тонн.
В 60 раз больше углекислого газа содержится в растворенном виде в морях и океанах.
В течение каждого года из атмосферы извлекается примерно 1/50 часть всего содержащегося в ней CO2 растительным покровом земного шара в процессе фотосинтеза, превращающего минеральные вещества в органические.
Основная масса углекислого газа в природе образуется в результате различных процессов разложения органических веществ. Углекислый газ выделяется при дыхании растений, животных, микроорганизмов. Непрерывно увеличивается количество углекислого газа, выделяемого различными производствами. Углекислый газ содержится в составе вулканических газов, выделяется он и из земли в вулканических местностях.
Вне земного шара оксид углерода (IV) обнаружен в атмосферах Марса и Венеры – планетах «земного типа».
В 60 раз больше углекислого газа содержится в растворенном виде в морях и океанах.
В течение каждого года из атмосферы извлекается примерно 1/50 часть всего содержащегося в ней CO2 растительным покровом земного шара в процессе фотосинтеза, превращающего минеральные вещества в органические.
Основная масса углекислого газа в природе образуется в результате различных процессов разложения органических веществ. Углекислый газ выделяется при дыхании растений, животных, микроорганизмов. Непрерывно увеличивается количество углекислого газа, выделяемого различными производствами. Углекислый газ содержится в составе вулканических газов, выделяется он и из земли в вулканических местностях.
Вне земного шара оксид углерода (IV) обнаружен в атмосферах Марса и Венеры – планетах «земного типа».
- Предыдущая
Презентация на тему Углекислый газ Следующая -
Презентация на тему Углекислый газ CO2  Металлы
Металлы Предельные одноатомные спирты
Предельные одноатомные спирты Ocena zawartości mikotoksyn w wybranych produktach spożywczych
Ocena zawartości mikotoksyn w wybranych produktach spożywczych анлекция 3
анлекция 3 10 класс Алкадиены более совершенная (2)
10 класс Алкадиены более совершенная (2) Шаблон презентации по химии
Шаблон презентации по химии Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза
Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза Ионные уравнения
Ионные уравнения Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов
Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов Химическое кафе «Кислоты»
Химическое кафе «Кислоты» Рубидий (лат. Rubidium)
Рубидий (лат. Rubidium) Алкины
Алкины Алкадиены
Алкадиены Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны
Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны Презентация по Химии "Введение в органическую химию в тезисах, аргументах и фактах"
Презентация по Химии "Введение в органическую химию в тезисах, аргументах и фактах"  Номенклатура и изомерия аренов
Номенклатура и изомерия аренов Разминка для болельщиков
Разминка для болельщиков Решение задач. Подготовка к контрольной работе по химии
Решение задач. Подготовка к контрольной работе по химии Основные виды сырья для промышленности органического и нефтехимического синтеза
Основные виды сырья для промышленности органического и нефтехимического синтеза Применение ЦОР на уроках биологии и химии
Применение ЦОР на уроках биологии и химии Сера в таблице Д.И. Менделеева
Сера в таблице Д.И. Менделеева Химия и жизнь
Химия и жизнь ВКР: Определение показателей качества мясной и колбасной продукции различных производителей
ВКР: Определение показателей качества мясной и колбасной продукции различных производителей Массовая доля элемента в веществе
Массовая доля элемента в веществе Гидролиз солей
Гидролиз солей Роль нитрадов. Взгляд специалистов
Роль нитрадов. Взгляд специалистов Материаловедение. Легированные стали и сплавы. (Тема 11)
Материаловедение. Легированные стали и сплавы. (Тема 11) Диаграммы состояния сплавов, компоненты которых имеют полиморфное превращение
Диаграммы состояния сплавов, компоненты которых имеют полиморфное превращение