Содержание
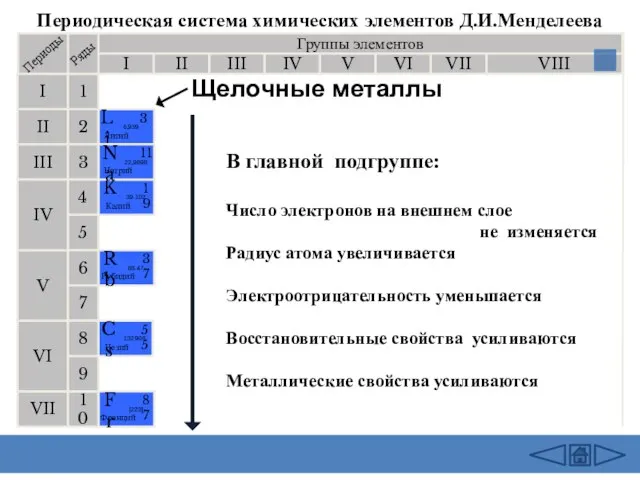
- 2. Щелочные металлы
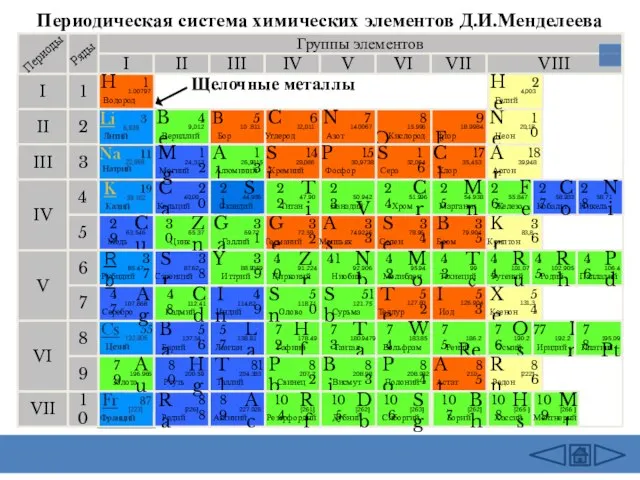
- 3. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 4. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 5. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 6. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 7. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 8. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 9. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 10. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
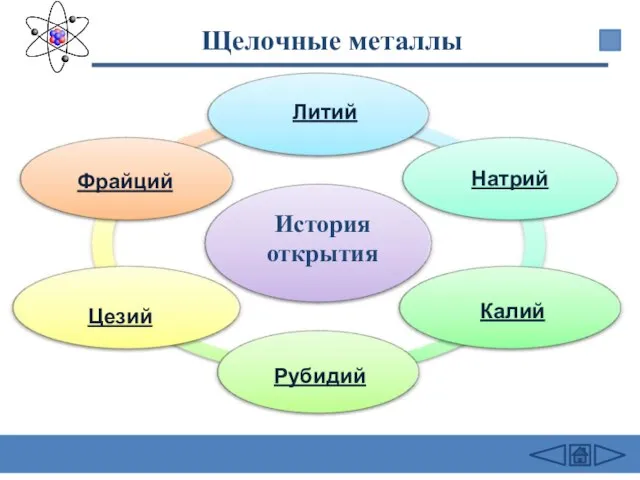
- 11. Щелочные металлы Литий Натрий Калий Рубидий Цезий Фрайций История открытия
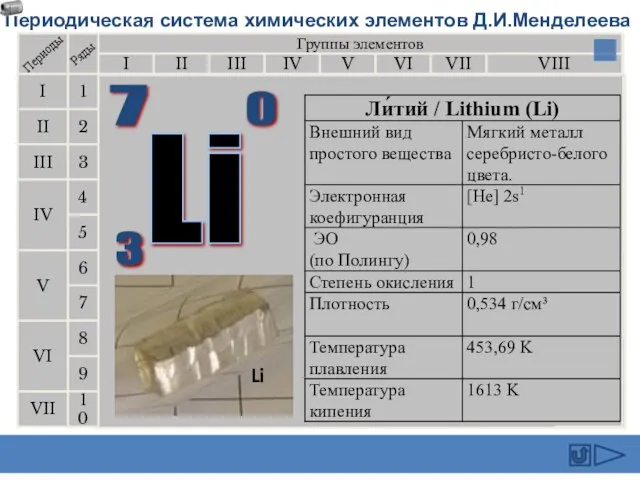
- 12. Литий был открыт в 1817 г. А. Арфведсоном в минерале петалите. Берцелиус предложил назвать ее литионом
- 13. Натрий (Natrium, от англ. и франц. Sodium, нем. Natrium от древнеевр. neter — бурлящее вещество. В
- 14. Калий (англ. Potassium, франц. Potassium, нем. Kalium) открыл в 1807 г. Г.Дэви, производивший электролиз твердого, слегка
- 15. При спектроскопическом анализе минерала лепидолит (фторсиликат лития и алюминия) и обнаружились две новые красные линии в
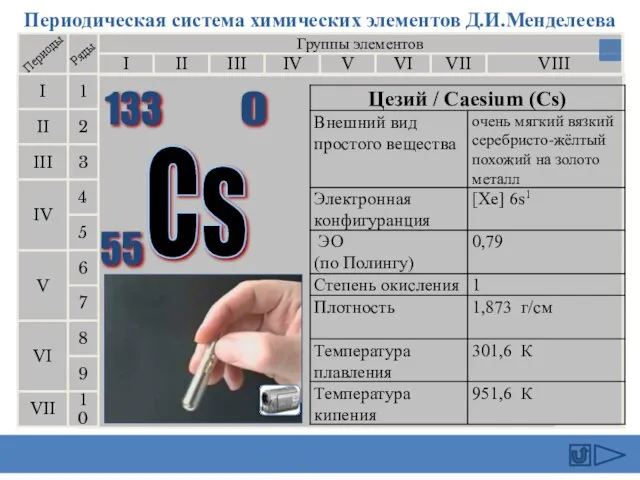
- 16. Цезий (англ. Cesium, франц. Cesium, нем. Caesium) - первый элемент, открытый с помощью спектрального анализа. Р.Бунзен
- 17. Этот элемент был предсказан Д.И.Менделеевым (как Эка-цезий), и был открыт (по его радиоактивности) в 1939 г.
- 18. Природные соединения лития Сподуменн
- 19. Природные соединения натрия Галит
- 20. Природные соединения калия Сильвин
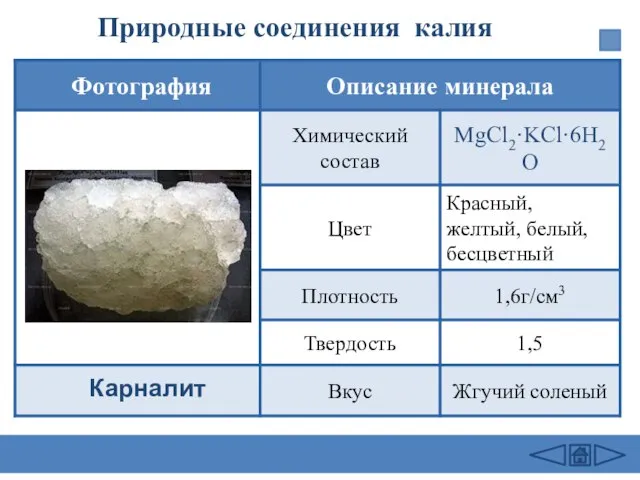
- 21. Природные соединения калия Карналит
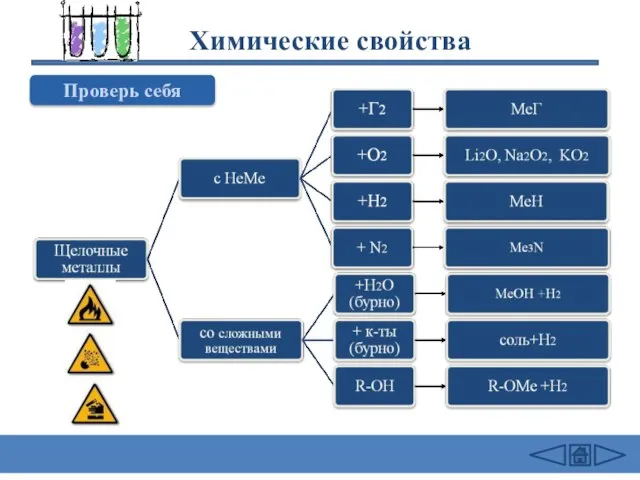
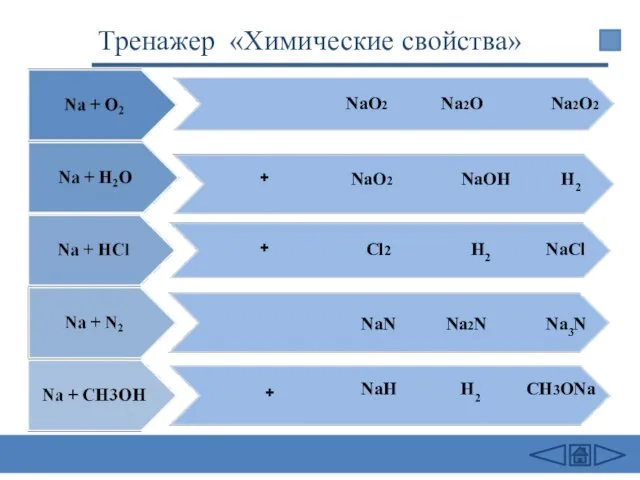
- 22. Химические свойства Проверь себя
- 23. Химические свойства 2Na + Cl2 = 2NaCl (в атмосфере F2 и Cl2 щелочные Me самовоспламеняются) 4Li
- 24. Качественное определение щелочных металлов Li+ Na+ K+ Для распознавания соединений щелочных металлов по окраске пламени исследуемое
- 25. 1) Электролиз расплавов соединений щелочных металлов: 2МеCl = 2Ме + Cl2 4МеOH = 4Ме + 2Н2О
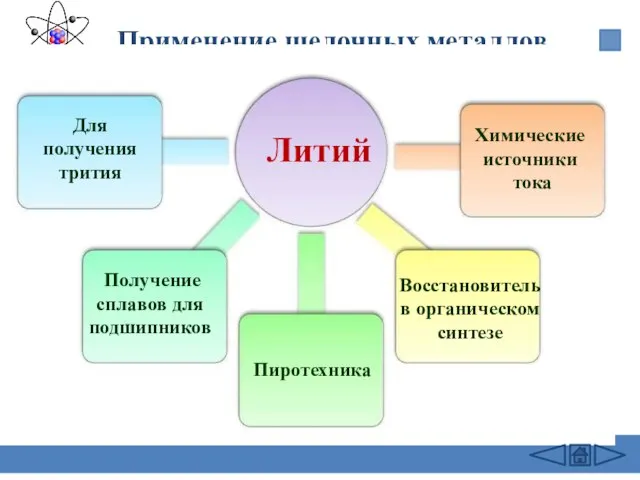
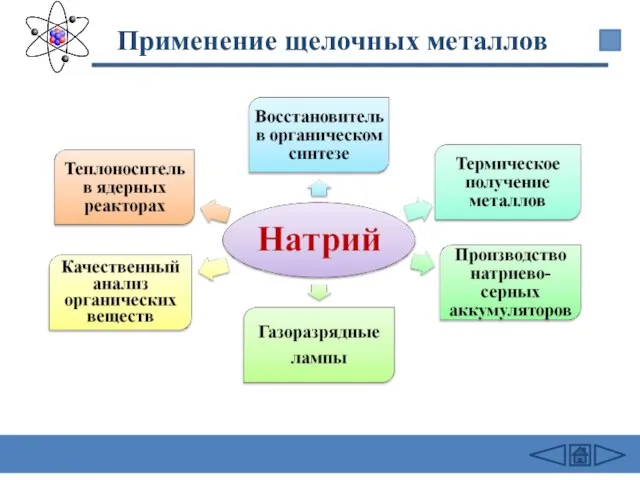
- 26. Применение щелочных металлов Литий Для получения трития Получение сплавов для подшипников Восстановитель в органическом синтезе Химические
- 27. Применение щелочных металлов
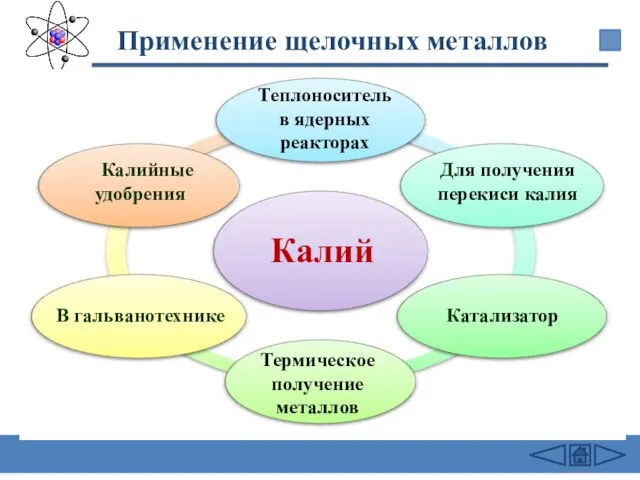
- 28. Применение щелочных металлов Калий В гальванотехнике Калийные удобрения Для получения перекиси калия Катализатор Термическое получение металлов
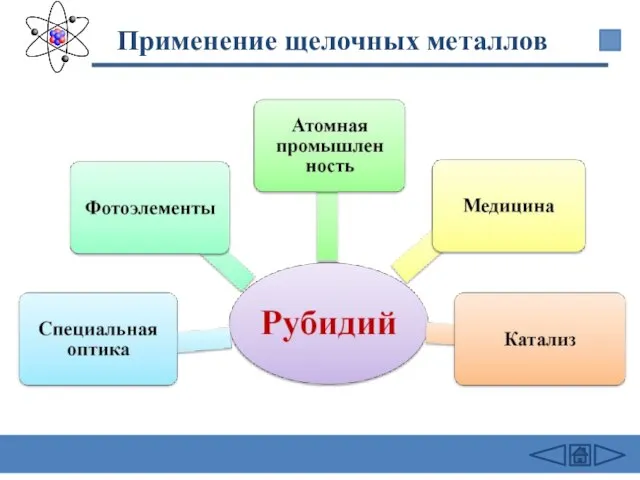
- 29. Применение щелочных металлов
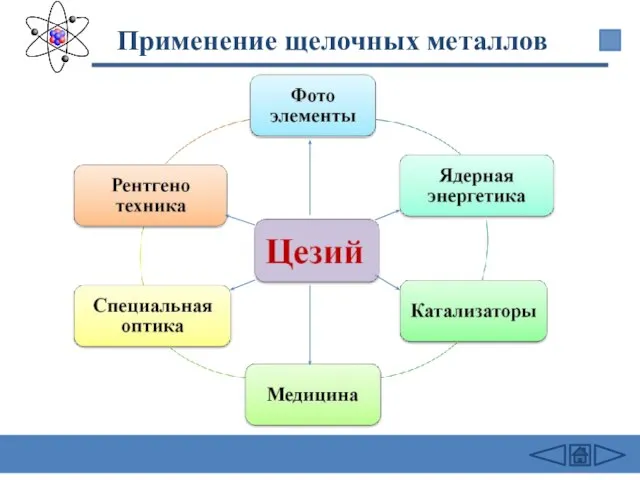
- 30. Применение щелочных металлов
- 31. Физические свойства щелочных металлов Щелочные металлы - серебристо–белые вещества, за исключением цезия - серебристо-желтого цвета, с
- 32. 1. Предложил назвать калий от арабского «алкали» - щелочь И. Арфведсон Г.Деви Й. Берцеллиус 2. В
- 33. + + + NаО2 Nа2O2 NаОН NaCl Na2N Na3N NаО2 Cl2 NaN NaH Na2O H2 H2
- 34. Габриелян О.С. Химия. 9 класс: Учеб. для общеобразоват.учебн. заведений.-М.: Дрофа, Ахметов Н. С. Общая и неорганическая
- 36. Скачать презентацию



















 Презентация на тему Химические вещества: строительные и поделочные материалы
Презентация на тему Химические вещества: строительные и поделочные материалы  Игра Кто хочет стать отличником? (за курс органической химии)
Игра Кто хочет стать отличником? (за курс органической химии) Chemsheets AS 1009 (Electron arrangement)
Chemsheets AS 1009 (Electron arrangement) Экономическое значение инвазионных болезней в агропромышленном комплексе. Химиопрофилактика инвазионных болезней
Экономическое значение инвазионных болезней в агропромышленном комплексе. Химиопрофилактика инвазионных болезней Презентация на тему Эфиры и жиры
Презентация на тему Эфиры и жиры  _Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1)
_Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1) Железо и его соединения. Строение атома железа
Железо и его соединения. Строение атома железа ИЗМЕНЕНИЕ СВОЙСТВ В ПЕРИОДАХ И ГРУППАХ
ИЗМЕНЕНИЕ СВОЙСТВ В ПЕРИОДАХ И ГРУППАХ Карбоновые кислоты, их строение, номенклатура, получение и свойства
Карбоновые кислоты, их строение, номенклатура, получение и свойства Судьба углеродного скелета аминокислот
Судьба углеродного скелета аминокислот Презентация на тему Фосфор
Презентация на тему Фосфор  Основной государственный экзамен. Химия 2022. Задание 2
Основной государственный экзамен. Химия 2022. Задание 2 Валентность химических элементов
Валентность химических элементов Сплавы алюминия. Их применение
Сплавы алюминия. Их применение Ферментативная кинетика
Ферментативная кинетика Вода. Растворы
Вода. Растворы 10_KISLOTNO_OSNOVNOE_TITROVANIE
10_KISLOTNO_OSNOVNOE_TITROVANIE Синтетические моющие средства
Синтетические моющие средства Химические равновесия в растворах. Лекция 2 часть 2
Химические равновесия в растворах. Лекция 2 часть 2 Силумины. Виды силуминов
Силумины. Виды силуминов Презентация на тему Природный газ
Презентация на тему Природный газ  Природные и синтетические красители
Природные и синтетические красители Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Магний и кальций
Магний и кальций Экспериментальные методы изучения кинетики химических реакции
Экспериментальные методы изучения кинетики химических реакции ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области
ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области Решение турнира. 9 класс
Решение турнира. 9 класс Сырье химической промышленности
Сырье химической промышленности