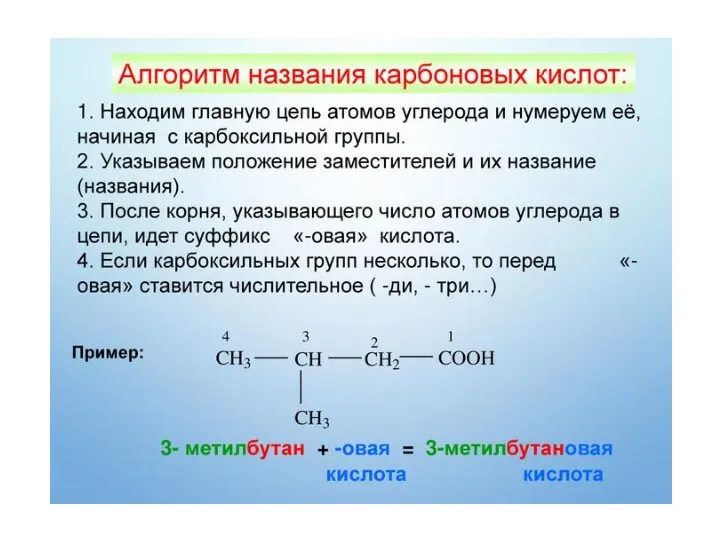
Содержание
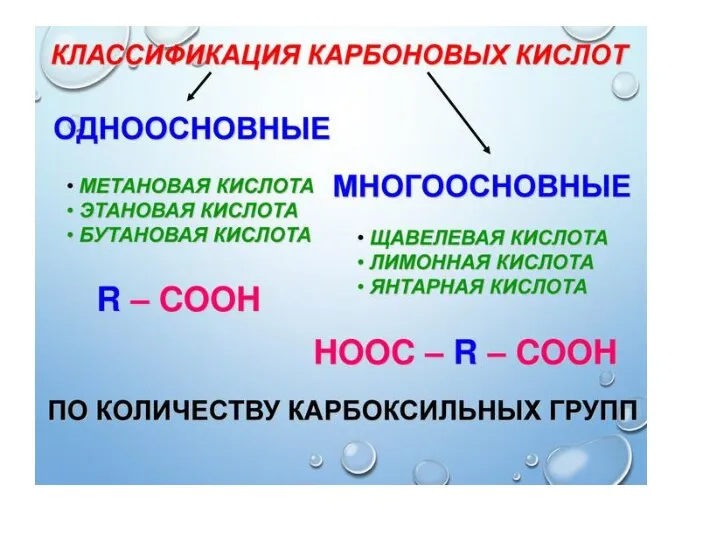
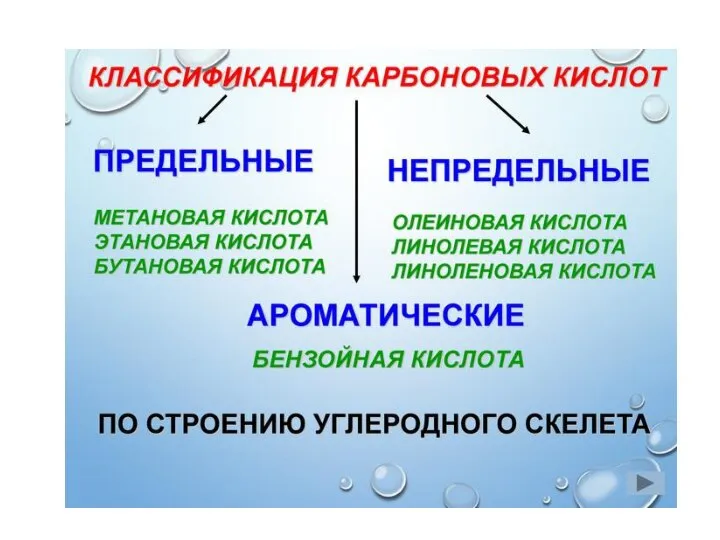
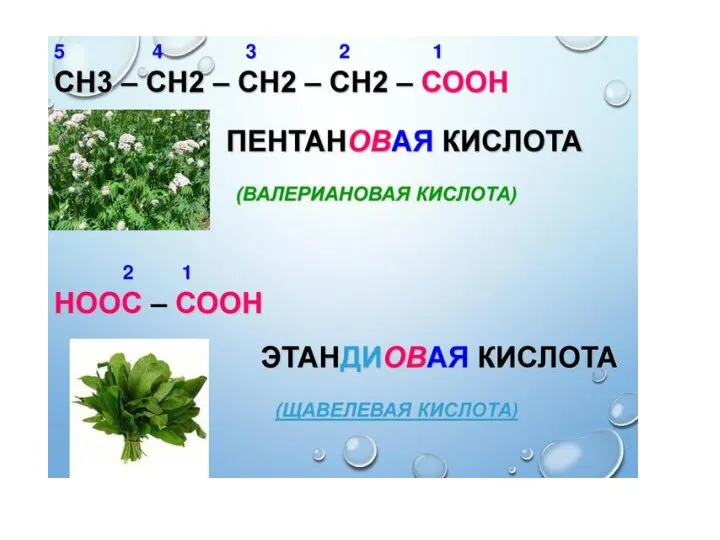
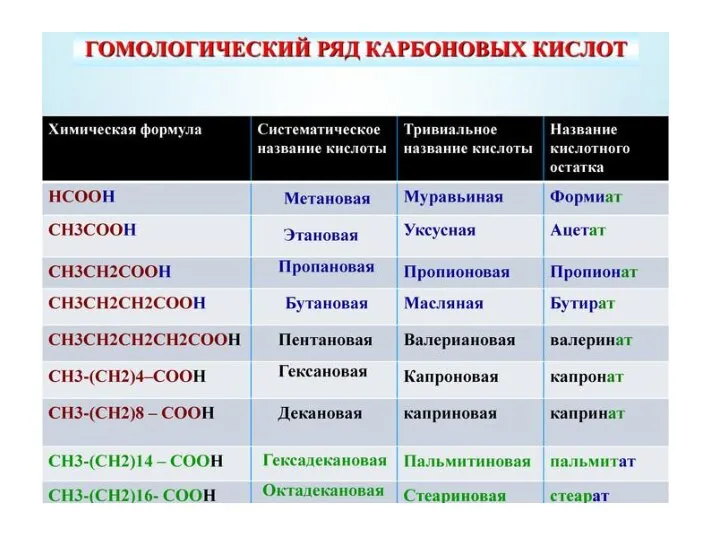
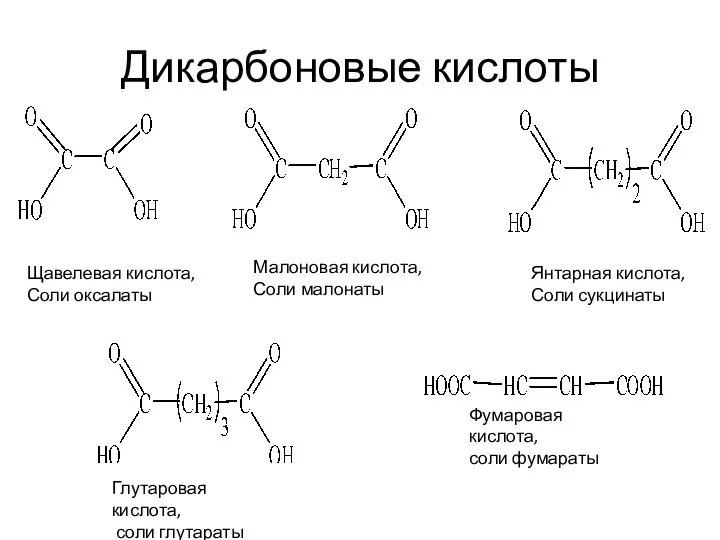
- 8. Дикарбоновые кислоты Щавелевая кислота, Соли оксалаты Малоновая кислота, Соли малонаты Янтарная кислота, Соли сукцинаты Глутаровая кислота,
- 12. Строение карбоксильной группы ● Электронная плотность в карбонильной группе (особенно σ-связи) смещена в сторону кислорода, как
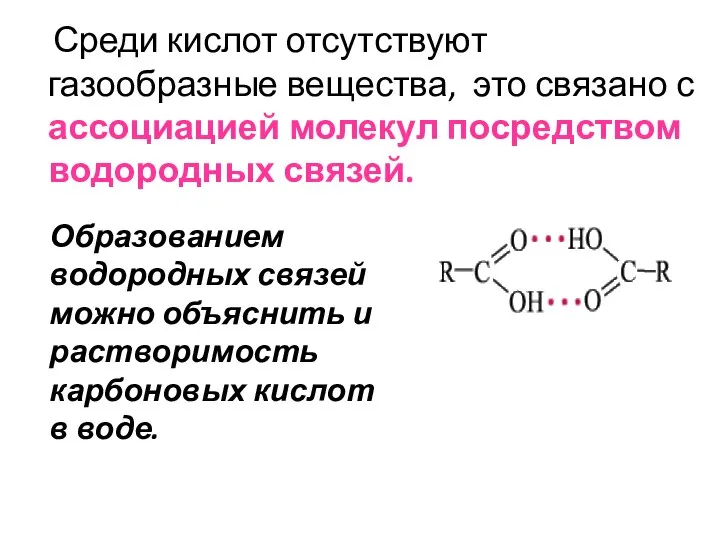
- 13. Среди кислот отсутствуют газообразные вещества, это связано с ассоциацией молекул посредством водородных связей. Образованием водородных связей
- 14. Реакционные центры:
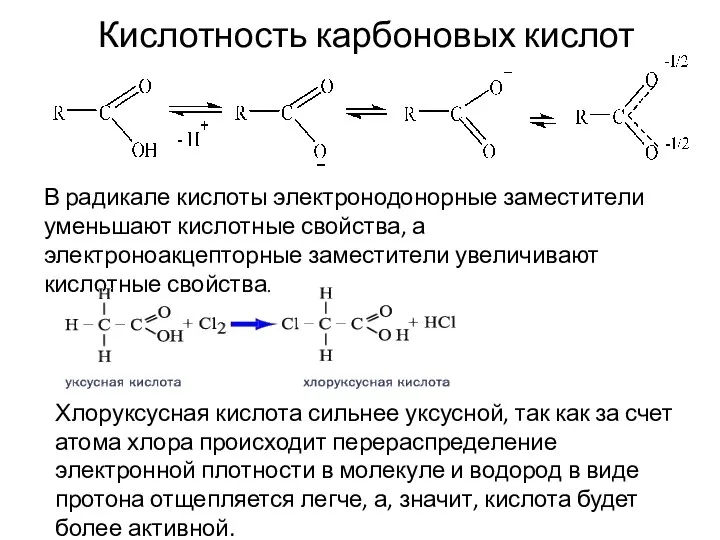
- 15. В радикале кислоты электронодонорные заместители уменьшают кислотные свойства, а электроноакцепторные заместители увеличивают кислотные свойства. Кислотность карбоновых
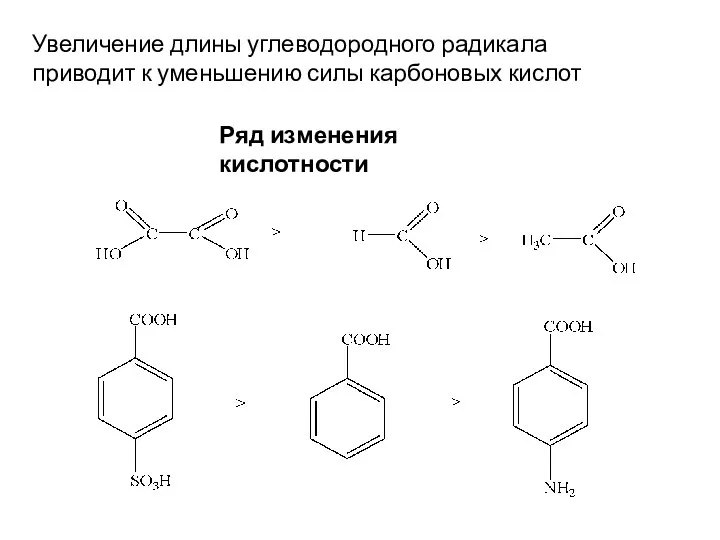
- 16. Увеличение длины углеводородного радикала приводит к уменьшению силы карбоновых кислот Ряд изменения кислотности
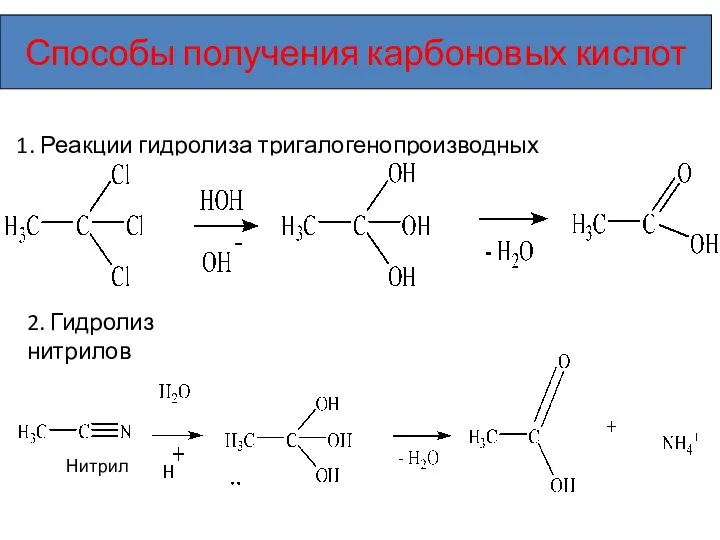
- 17. Способы получения карбоновых кислот 1. Реакции гидролиза тригалогенопроизводных 2. Гидролиз нитрилов Нитрил
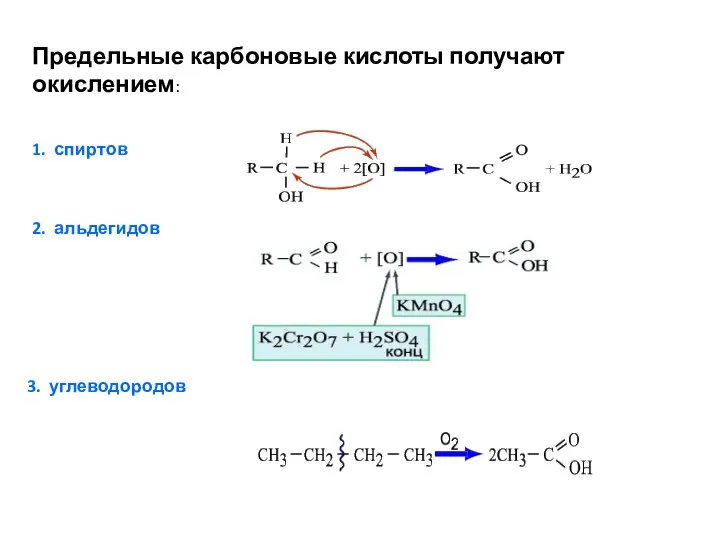
- 18. Предельные карбоновые кислоты получают окислением: 1. спиртов 2. альдегидов 3. углеводородов
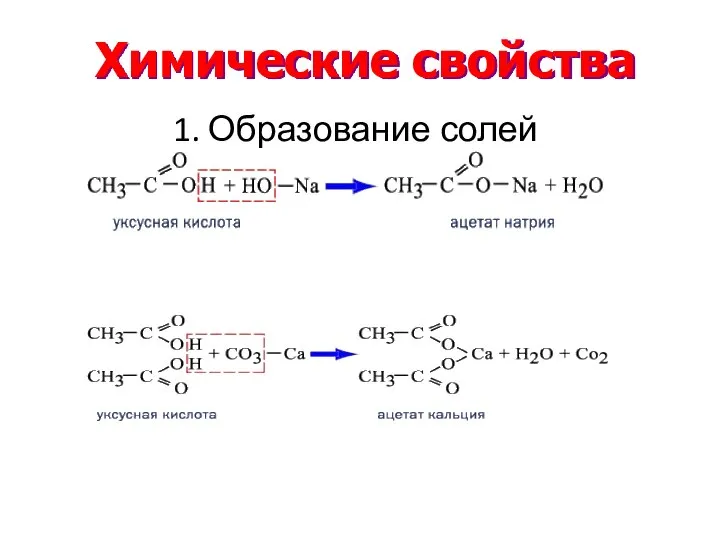
- 19. Химические свойства 1. Образование солей
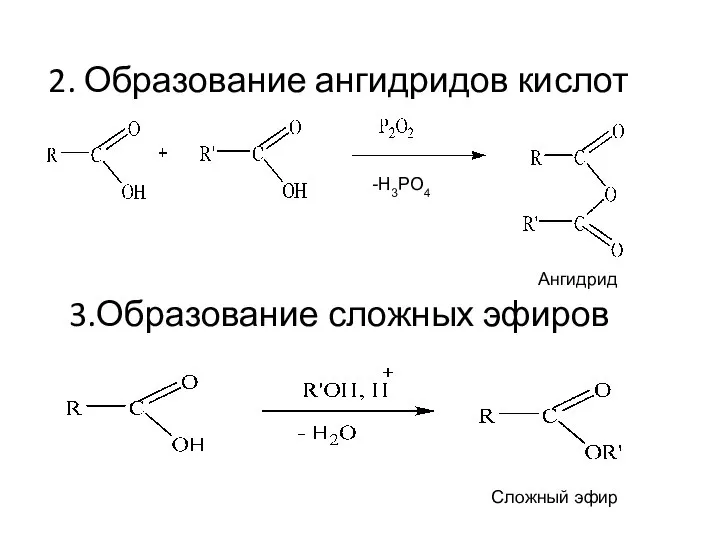
- 20. 2. Образование ангидридов кислот 3.Образование сложных эфиров -Н3РО4 Ангидрид Сложный эфир
- 22. Скачать презентацию






 Свойство металлов и сплавов
Свойство металлов и сплавов Энергосбережение в нашей жизни
Энергосбережение в нашей жизни Предельные одноосновные карбоновые кислоты
Предельные одноосновные карбоновые кислоты Особенности решения практикоориентированного задания №26 ГИА-11
Особенности решения практикоориентированного задания №26 ГИА-11 Маска откройся
Маска откройся Природный газ
Природный газ Дисперсные системы и поверхностные явления
Дисперсные системы и поверхностные явления Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Сера, значение и применение
Сера, значение и применение Основные обозначения. Основные понятия. Практическая работа № 2
Основные обозначения. Основные понятия. Практическая работа № 2 Зависимость знака заряда белка от pH
Зависимость знака заряда белка от pH Строение атома
Строение атома Основи масообміну
Основи масообміну Кислоты. Классификация кислот
Кислоты. Классификация кислот Алкены
Алкены Определение содержание фосфатов в воде фотометрическим методом
Определение содержание фосфатов в воде фотометрическим методом Презентация на тему Вопросы от …
Презентация на тему Вопросы от …  Атом. Изотопы
Атом. Изотопы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Ca КАЛЬЦИЙ
Ca КАЛЬЦИЙ Презентация на тему Полисахариды
Презентация на тему Полисахариды  Алкадиены. Физические свойства
Алкадиены. Физические свойства Химия – это наука о …
Химия – это наука о … Портландцемент гидравликалық байланыстырғыш
Портландцемент гидравликалық байланыстырғыш Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу химия конеч 3.0
химия конеч 3.0 Вычисление массовой доли элемента в молекуле
Вычисление массовой доли элемента в молекуле Метод МО Хюккеля (МОХ)
Метод МО Хюккеля (МОХ)