Содержание
- 2. I группа подразделяется на: IА-группу (S-элементы- щелочные металлы) и IIВ – группу (d элементы Cu Ag
- 3. К металлам главной подгруппы I группы относятся: Li Na K Rb Cs Fr.
- 4. Очень мягкие металлы, легко режутся ножом. На срезе - белого цвета с серебристым металлическим блеском, исчезающим
- 5. Химические свойства
- 6. Т.к. щелочные металлы - это самые сильные восстановители, их можно восстановить из соединений только при электролизе
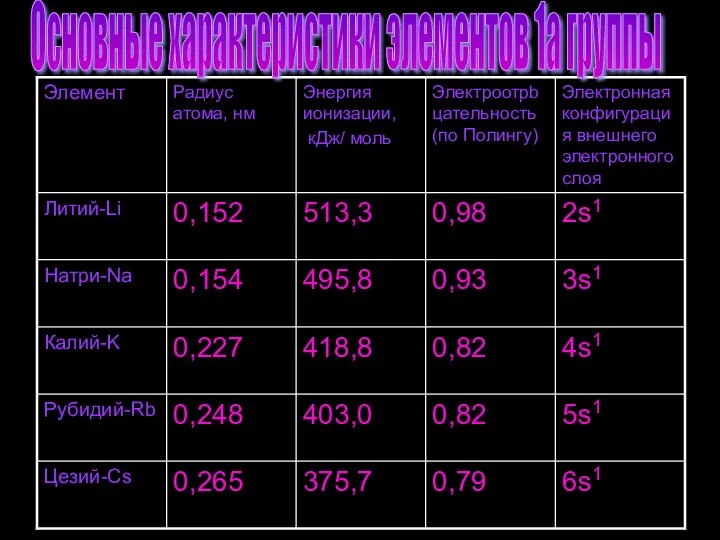
- 7. Основные характеристики элементов 1а группы
- 8. Натрий – элемент 3-го периода и IА-группы Периодической системы. Порядковый номер 11 Атомная масса 22,9898 Злектронный
- 9. Натрий открыт в 1807 г. английским химиком и физиком Г. Дэви при электролизе влажного едкого натра
- 10. 1. Энергично взаимодействуют со многими неметаллами: 2Nа + Cl2 = 2NaCl (хлорид натрия) 2. С ртутью
- 11. В природе натрий – пятый по распространенности элемент (второй среди металлов), находится только в виде соединений.
- 12. Натрий используется как теплоноситель- в сплаве с калием, в атомной энергетике, в ядерных установках. Как восстановитель
- 14. Скачать презентацию










 Водород
Водород Термодинамика. Основные понятия и законы. Особенности термодинамики живых систем
Термодинамика. Основные понятия и законы. Особенности термодинамики живых систем Строение атома. Экзаменационные вопросы
Строение атома. Экзаменационные вопросы Кислоты, их состав и название
Кислоты, их состав и название Белки. Тест
Белки. Тест Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота Все о пище с точки зрения химии
Все о пище с точки зрения химии Карбоновые кислоты
Карбоновые кислоты Ионы кальция, как важное звено в нейроцитотоксическом действии кадмия
Ионы кальция, как важное звено в нейроцитотоксическом действии кадмия Материаловедение
Материаловедение Основные понятия химической термодинамики
Основные понятия химической термодинамики Аналитическая химия как наука. Лекция 1
Аналитическая химия как наука. Лекция 1 Презентация на тему Строение атома и атомного ядра
Презентация на тему Строение атома и атомного ядра  Основы теории сплавов. Типы сплавов (твердые растворы, сплавы-смеси, сплавы- химические соединения. Диаграммы
Основы теории сплавов. Типы сплавов (твердые растворы, сплавы-смеси, сплавы- химические соединения. Диаграммы Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Строение, свойства, биологическая роль дезоксисахаров и аминосахаров
Строение, свойства, биологическая роль дезоксисахаров и аминосахаров Наука ковала Победу. 1941-1945
Наука ковала Победу. 1941-1945 Диэлектрики
Диэлектрики Структура к свойства веществ
Структура к свойства веществ Судың диссоциациясы
Судың диссоциациясы Метионин
Метионин Критерии оценки качества природного газа
Критерии оценки качества природного газа Соединения железа
Соединения железа Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа
Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа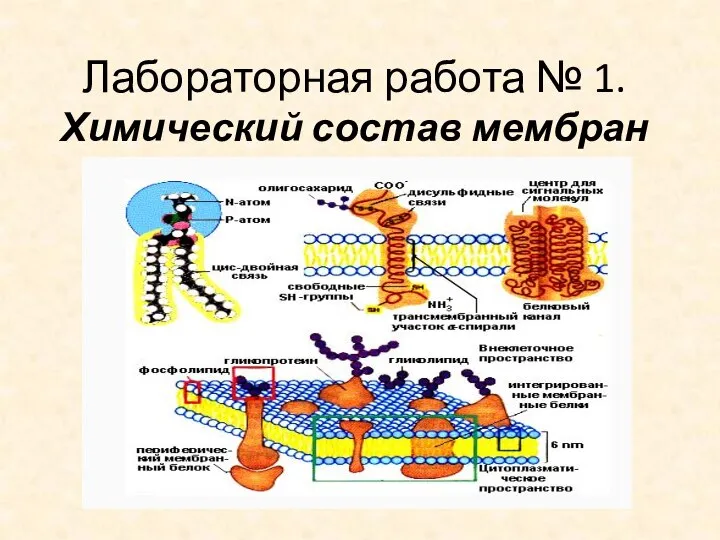 Химический состав мембран. Лабораторная работа № 1
Химический состав мембран. Лабораторная работа № 1 Ионообменная хроматография в разделении белков
Ионообменная хроматография в разделении белков Окислительно-восстановительные реакции
Окислительно-восстановительные реакции