Слайд 2Цель:
Изучение строения атомов щелочноземельных металлов, физических и химических свойств.

Слайд 3Положение в периодической таблице
Be Mg Ca Sr Ba Ra
Восстановительные свойства усиливаются

Слайд 4Строение атома
+4 ) )
+12 ) ) )
+20 ) ) )

)
+38 ) ) ) ) )
+56 ) ) ) ) ) )
Ве
Mg
Ca
Sr
Ba
2
2
2
2
2
Слайд 5Распишите электронные формулы всех элементов
6
3S
Ве
Mg

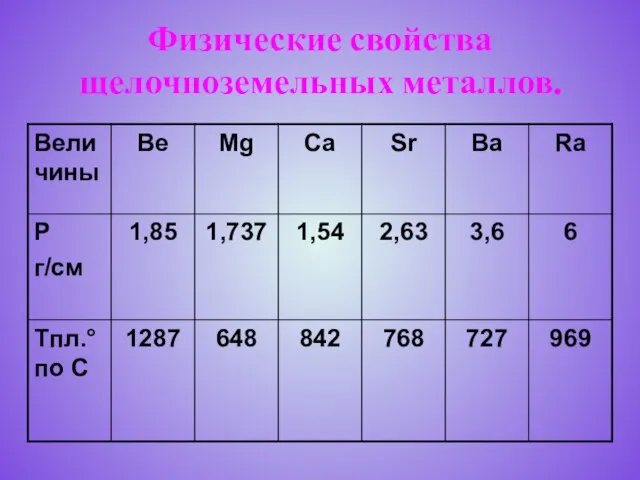
Слайд 6Физические свойства щелочноземельных металлов.
Слайд 7Химические свойства
1.Взаимодйествие с простыми веществами:
А) с кислородом
2Са+ О2= 2СаО
Б) с галогенами
Са +Сl2=

CaCl2
В) с водородом
Са +Н2 = СаН2
Г) с азотом
3Са + N2 = Ca3N2
Слайд 8Химические свойства
2. Взаимодействие со сложными веществами.
а) с водой
Са + 2Н2О = Са(ОН)2

+ Н2
б) с солями менее активных металлов
Mg +CuSO4 =Cu +MgSO4
в) с оксидами металлов
FeO + Mg = MgO +Fe
Его используют для получения чистых металлов из оксидов. Этот способ получил название магниотермия.
Слайд 9Mg +2HCl = MgCl2 +H2
Са с разбавленными кислотами не реагирует
Взаимодействие с кислотами

Слайд 10Соединения щелочноземельных металлов

Слайд 11Выполните следующее задание:
Решить задачу №1после §12
Осуществить превращения:
Ca → CaO→ CaCl2→ Ca(OH)2 →
CaCO3

→CaO










 Свойства нефти
Свойства нефти Пултаруллă
Пултаруллă Камень, скользящий на льду
Камень, скользящий на льду MPKh_PREZENTATsIYa_2
MPKh_PREZENTATsIYa_2 Вспоминаем химию
Вспоминаем химию Опис технологічного процесу отримання смол бекелітових рідких марок
Опис технологічного процесу отримання смол бекелітових рідких марок Аммиа́к (нитрид водорода)
Аммиа́к (нитрид водорода) 7609f31d31514fe19b6df19a98197139 (1)
7609f31d31514fe19b6df19a98197139 (1) Голубое золото
Голубое золото Классификация неорганических веществ
Классификация неорганических веществ Бинарные соединения – оксиды и летучие водородные соединения. 8 класс
Бинарные соединения – оксиды и летучие водородные соединения. 8 класс Презентация на тему Ферменты и гормоны
Презентация на тему Ферменты и гормоны  Определение качества дизельного топлива
Определение качества дизельного топлива Химия вокруг нас. 10 класс
Химия вокруг нас. 10 класс Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза
Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза Классификация нефтей. Основы переработки нефти и нефтепродуктов
Классификация нефтей. Основы переработки нефти и нефтепродуктов Основания Сложные вещества
Основания Сложные вещества 897386 (2)
897386 (2) Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры
Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс Влияние спиртов на организм человека
Влияние спиртов на организм человека Презентация на тему Изомерия. Изомеры
Презентация на тему Изомерия. Изомеры  Химия в системе современных естественнонаучных представлений
Химия в системе современных естественнонаучных представлений Празеодим
Празеодим Необратимый (совместный) гидролиз
Необратимый (совместный) гидролиз Подготовка к ГИА 2021
Подготовка к ГИА 2021 Неметаллы
Неметаллы Презентация на тему Химия и пища
Презентация на тему Химия и пища