Содержание
- 2. Основания – сложные вещества, которые состоят из катиона металла Ме+ (или металлоподобного катиона, например, иона аммония
- 3. 1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми. При этом образуются средняя соль
- 4. Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты
- 5. щёлочь (расплав) + амфотерный оксид = средняя соль + вода щёлочь (расплав) + амфотерный гидроксид =
- 6. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от
- 7. Щёлочи реагируют только с растворимыми солями в растворе, при условии, что в продуктах образуется газ или
- 8. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли. кислая соль
- 9. 1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом
- 10. Нерастворимые основания разлагаются при нагревании на оксид и воду. Например, гидроксид железа (III) разлагается на оксид
- 11. 3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами. нерастворимое оснвоание + амфотерный оксид ≠
- 13. Скачать презентацию










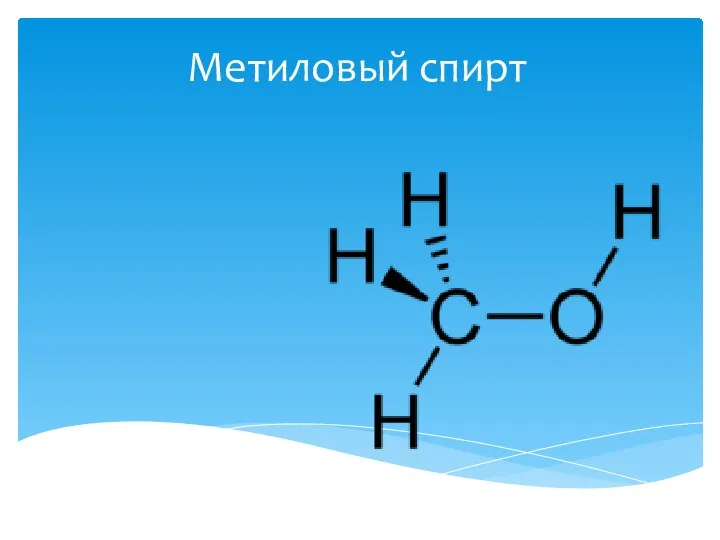 Метиловый спирт
Метиловый спирт Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6
Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6 Техника титрования и лабораторная посуда
Техника титрования и лабораторная посуда Гибридизация
Гибридизация Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу
Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу Оценивание эффективности многофункциональной присадки для бензинов
Оценивание эффективности многофункциональной присадки для бензинов Общая характеристика оксидов
Общая характеристика оксидов Алкадиены. Каучук. История открытия каучука
Алкадиены. Каучук. История открытия каучука Нихром. Физические свойства
Нихром. Физические свойства Алкадиены: номенклатуры, изомерия. Тест
Алкадиены: номенклатуры, изомерия. Тест Щелочно-земельные металлы и магний
Щелочно-земельные металлы и магний Характеристика кислорода как химического элемента и простого вещества
Характеристика кислорода как химического элемента и простого вещества Свойства химической связи
Свойства химической связи Л1.4. Диаграмма железо-углерод
Л1.4. Диаграмма железо-углерод Презентация на тему Ковалентная неполярная связь
Презентация на тему Ковалентная неполярная связь  Презентация на тему Этиловый спирт и его влияние на здоровье человека
Презентация на тему Этиловый спирт и его влияние на здоровье человека  Алканы: гомологический ряд, строение, номенклатура, физические свойства
Алканы: гомологический ряд, строение, номенклатура, физические свойства Порядок в жидкостях
Порядок в жидкостях Молярная масса вещества
Молярная масса вещества Презентация на тему Общая жесткость воды
Презентация на тему Общая жесткость воды  Химические свойства оснований
Химические свойства оснований День химии
День химии Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем
Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем Вывод и обсуждение
Вывод и обсуждение Кристаллические решетки
Кристаллические решетки Углеводы: моно-, олиго- и полисахариды
Углеводы: моно-, олиго- и полисахариды Презентация на тему Химическая связь (8 класс)
Презентация на тему Химическая связь (8 класс)  Химический футбол на тему: Химия вокруг нас
Химический футбол на тему: Химия вокруг нас