Содержание
- 2. Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. Например: CaO, SO2,
- 3. Оксиды Оксиды – соединения элементов с кислородом (кроме соединений фтора). Степень окисления кислорода в оксидах равна
- 4. Способы получения оксидов. Взаимодействие простых веществ с кислородом: 2Mg + O2 = 2Mg O 2. Горение
- 5. Классификация оксидов Оксиды Соле- образующие основные кислотные амфотерные Несоле- образующие
- 6. Несолеобразующие оксиды Это оксиды, которые не взаимодействуют ни с кислотами, ни с основаниями и не образуют
- 7. Основные оксиды Это оксиды, которым в качестве гидроксидов соответствуют основания. Например: CuO → Cu(OH)2 Основные оксиды
- 8. Химические свойства основных оксидов. Взаимодействие с кислотами, с образованием соли и воды: MgO + HCl =
- 9. Кислотные оксиды Это оксиды, которым в качестве гидроксидов соответствуют кислоты. Например: SO3 → H2SO4 Кислотные оксиды
- 10. Химические свойства кислотных оксидов. С основаниями, образуя соль и воду: CO2 + 2KOH = K2CO3 +
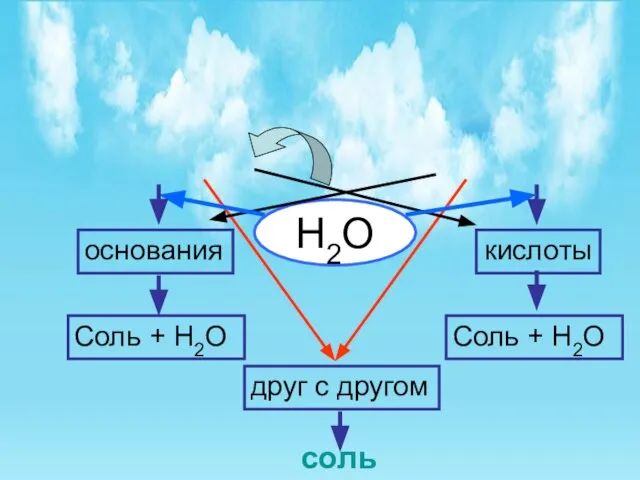
- 11. Н2О Соль + Н2О Соль + Н2О друг с другом соль основания кислоты
- 12. АМФОТЕРНЫЕ ОКСИДЫ. Это оксиды, которым соответствуют гидроксиды, проявляющие свойства как оснований, так и кислот. Например: BeO
- 13. Химические свойства амфотерных оксидов. В качестве основных оксидов. С кислотами, образуя соль и воду: ZnO +
- 14. Вывод. С повышением степени окисления атомов элемента, образующего оксиды, увеличиваются кислотные свойства его оксидов и гидроксидов.
- 15. Газ, необходимый растениям для фотосинтеза Содержание углекислого газа в атмосфере относительно невелико, всего 0,04—0,03%. В воздухе,
- 16. Один из распространенных оксидов – диоксид углерода CO2 – содержится в составе вулканических газов. В природе
- 17. Cухой лед – тоже CO2 Сухой лед в отличие от водяного льда плотный. Он тонет в
- 18. Оксид хрома(III) – Cr2O3 –кристаллы зеленого цвета, нерастворимые в воде. Cr2O3 используют как пигмент при изготовлении
- 19. Оксид магния MgO Оксид магния – основный оксид. Магниевая лента, вступив в реакцию с кислородом воздуха,
- 20. Оксид кремния (IV) SiO2 Плиний считал, что горный хрусталь «рождается из небесной влаги и чистейшего снега».
- 21. Оксид цинка ZnO – вещество белого цвета, используется для приготовления белой масляной краски (цинковые белила). Цинковыми
- 22. Задания. Определите характер данных оксидов CO2, ZnO, Na2O, SO2, CaO, NO и напишите соответствующие им гидроксиды.
- 24. Скачать презентацию




















 Заманауи косметика биотехнологиясы
Заманауи косметика биотехнологиясы Кислотно-основное равновесие
Кислотно-основное равновесие Производство азотных удобрений
Производство азотных удобрений Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Химическая картина мира
Химическая картина мира Биосинтез фенольных соединений в растениях
Биосинтез фенольных соединений в растениях Строение атома. История открытия
Строение атома. История открытия Презентация на тему Химическая связь и её типы
Презентация на тему Химическая связь и её типы  Химия. Введение в предмет (8 класс)
Химия. Введение в предмет (8 класс) Агрегатное состояние вещества
Агрегатное состояние вещества Спирты. Классификация
Спирты. Классификация Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Экстракция
Экстракция Углеводороды
Углеводороды Количество вещества. Решение задач
Количество вещества. Решение задач День химии
День химии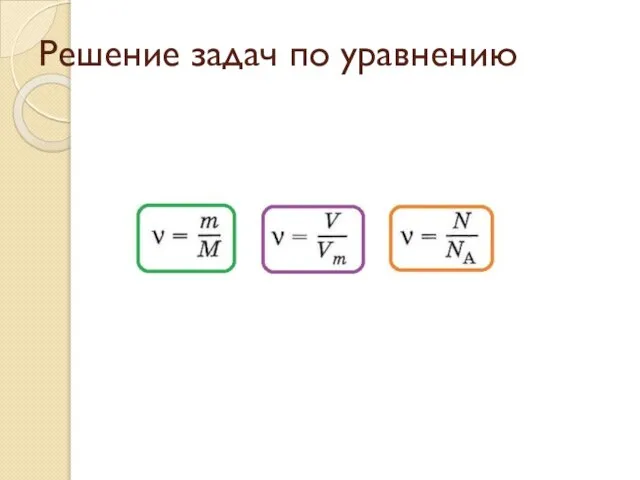 Решение задач по уравнению
Решение задач по уравнению Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Применение спиртов
Презентация на тему Применение спиртов  Коррозия металлов
Коррозия металлов Чему равно общее количество электронов в атоме?
Чему равно общее количество электронов в атоме? Состав и свойства нефти. Химический состав нефтяной смеси
Состав и свойства нефти. Химический состав нефтяной смеси Строение вещества
Строение вещества Все о пище с точки зрения химии
Все о пище с точки зрения химии Решение задач на основные законы и понятия химии
Решение задач на основные законы и понятия химии Растворение +СО2 + в +Н2О. Агрегатное состояние вещества
Растворение +СО2 + в +Н2О. Агрегатное состояние вещества Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол
Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол Химически опасные объекты Аварии, связанные с выбросом АХОВ
Химически опасные объекты Аварии, связанные с выбросом АХОВ