Слайд 2Гибридизация – это смешение атомных орбиталей различного типа (например, s, p и

d), в результате которого образуются одинаковые по форме и энергии гибридные орбитали (например, sp3, sp2 ,sp и т.д. ).
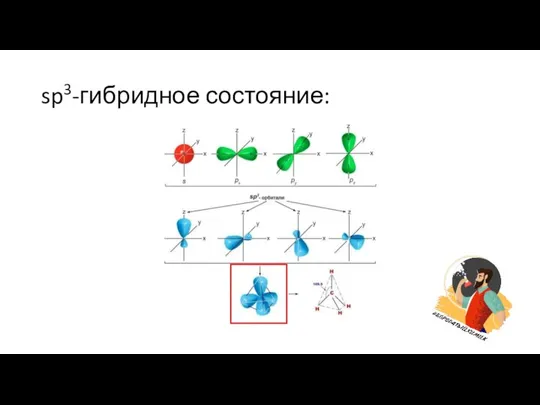
Слайд 4Особенности sp3-гибридного состояния:
Форма молекулы – тетраэдр;
Угол между связями в симметричной

молекуле – 109˚28’ (если в молекуле гибридизуется неподеленная электронная пара, угол может меняться);
Характерна для молекул алканов, циклоалканов, воды, аммиака, насыщенных спиртов и аминов, так же для атомов О, С, N, не содержащих кратных связей.
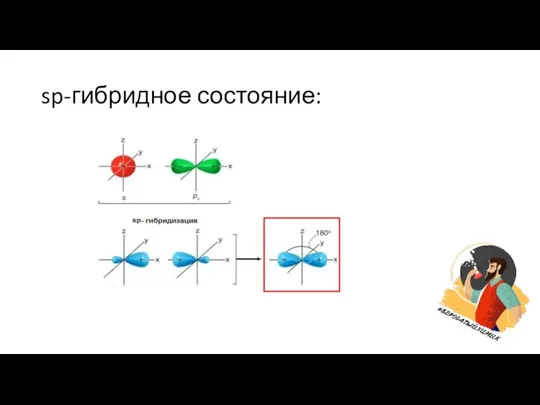
Слайд 5sp2-гибридное состояние:
sp2 – гибридизация
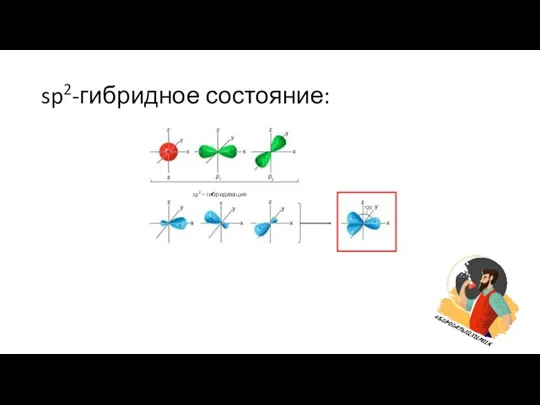
Слайд 6Особенности sp2-гибридного состояния:
Форма молекулы – треугольник;
Угол между связями в симметричной молекуле

- 120˚;
Характерна для атомов О, С, N, с одной двойной связью. Т.е. следующих классов веществ: алкены, диены, арены, циклоалкены, циклодиены и многие другие.




 Порядок в жидкостях
Порядок в жидкостях Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства
Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН
Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН Карбоновые кислоты
Карбоновые кислоты Презентация на тему Валентные состояния атома углерода
Презентация на тему Валентные состояния атома углерода  Роль элементов 5 группы
Роль элементов 5 группы Презентация на тему Уксусная кислота
Презентация на тему Уксусная кислота  Гидролиз солей. Какие типы гидролиза возможны?
Гидролиз солей. Какие типы гидролиза возможны? Выращивание кристаллов соли (домашний эксперимент)
Выращивание кристаллов соли (домашний эксперимент) Белки
Белки Основные классы неорганических веществ
Основные классы неорганических веществ Химическая связь и строение вещества
Химическая связь и строение вещества Смог як хімічне явище
Смог як хімічне явище Презентация на тему Интеллект – мой выбор
Презентация на тему Интеллект – мой выбор  Изучение свойств азотной кислоты для учащихся 9 классов
Изучение свойств азотной кислоты для учащихся 9 классов Стекло. Технология изготовления стекла
Стекло. Технология изготовления стекла Вещество и тело. Атом и молекула. Свойства веществ. Простые и сложные вещества. Химический элемент
Вещество и тело. Атом и молекула. Свойства веществ. Простые и сложные вещества. Химический элемент Гипер-гипофосфатемия
Гипер-гипофосфатемия Алкины
Алкины Оксиды, их классификация. Свойства оксидов в свете теории электролитической диссоциации
Оксиды, их классификация. Свойства оксидов в свете теории электролитической диссоциации Физические и химические свойства алкенов
Физические и химические свойства алкенов Презентация на тему Неорганічні речовини живих організмів
Презентация на тему Неорганічні речовини живих організмів  Единые смеси
Единые смеси Какую воду мы пьем
Какую воду мы пьем Кристаллическое состояние воды - лёд
Кристаллическое состояние воды - лёд Объёмный анализ
Объёмный анализ ліпіди
ліпіди Окислительно-восстановительные реакции
Окислительно-восстановительные реакции