Слайд 2ПЛАН:
Закон сохранения массы
Закон постоянства состава
Закон эквивалентов
Закон Авогадро
Закон Клайперона-Менделеева

Слайд 3ЗАКОН СОХРАНЕНИЯ МАССЫ
Закон сохранения массы теоретически был описан в 1748 году, а экспериментально

подтверждён в 1756 году русским ученым М.В. Ломоносовым. В 1789 году французский учёный Антуан Лавуазье подтвердил выводы Ломоносова.
Слайд 4ЗАКОН СОХРАНЕНИЯ МАССЫ
Масса веществ, вступающих в реакцию, равна массе веществ, образующихся в

результате реакции
Слайд 5Модель химической реакции.
Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических
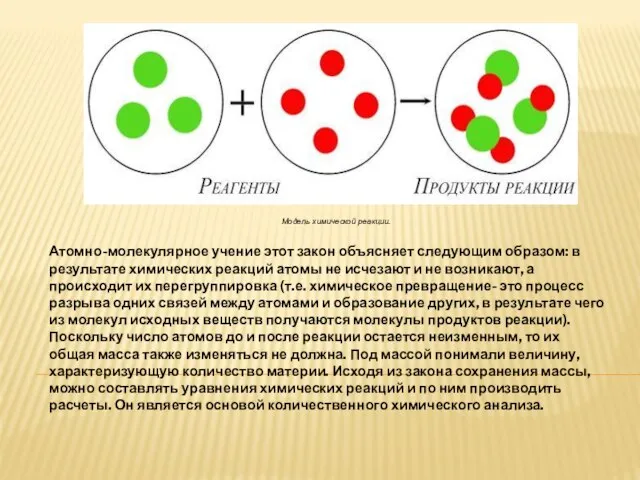
реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Под массой понимали величину, характеризующую количество материи. Исходя из закона сохранения массы, можно составлять уравнения химических реакций и по ним производить расчеты. Он является основой количественного химического анализа.
Слайд 6ПРИМЕР:
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH.
Массы исходных и конечных веществ

составят:
3·126 + 2·158 + 18 = 3·142 + 2·87 + 2·56,
т.е. масса исходных веществ (712 г) равна массе продуктов реакции (712 г).
Слайд 7ПРАВИЛА СОСТАВЛЕНИЯ ХИМИЧЕСКИХ УРАВНЕНИЙ:
Необходимо знать формулы веществ, вступивших в реакцию (реагентов) и

формулы веществ, полученных в результате реакции (продукты реакции).
Число атомов каждого элемента в левой части уравнения должно быть равно числу атомов этих же элементов в правой части уравнения. Для уравновешивания подбирают и расставляют перед формулами соответствующие коэффициенты.
Левую и правую части уравнения нельзя менять местами.
Нельзя переносить формулы веществ из одной части уравнения в другую.
Слайд 11ЗАКОН ПОСТОЯНСТВА СОСТАВА
был открыт французским ученым Жозефом Луи Прустом в 1808 г.

Слайд 12ЗАКОН ПОСТОЯНСТВА СОСТАВА
Вот как этот закон звучал в его изложении:
«От одного

полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь».
Современная формулировка закона: каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав.
Слайд 13
Чтобы получить сульфид меди (CuS) необходимо смешать порошки меди и серы в

массовых отношениях 2 : 1.
Если взятые количества исходных веществ не соответствуют их соотношению в химической формуле соединения, одно из них останется в избытке.
Например, если взять 3 г меди и 1 г серы, то после реакции останется 1 г меди, который не вступил в химическую реакцию. Вещества немолекулярного строения не обладают строго постоянным составом. Их состав зависит от условий получения.
Слайд 14Например, оксид кальция состоит из кальция и кислорода (качественный состав). В СаO

содержится 71,43 мас.% кальция и 28,57 мас.% кислорода (количественный состав). Получить оксид кальция можно в результате реакций:
2 Са + О2 = 2 СаО,
СаСО3 = СаО + СО2,
Са(ОН)2 = СаО + Н2О,
2 Сa(NO3)2 = 2 CaO + 4 NO2 + O2.
Однако независимо от способа получения, чистый оксид кальция будет иметь приведенный выше состав.
Слайд 15ЗАКОН ЭКВИВАЛЕНТОВ.
В конце XVIII века были получены эмпирическим путем многие законы

химии. Ими можно было пользоваться и применять их на практике, но точное доказательство было получено лишь много десятилетий спустя. Одним из таких столпов современной химии стал закон эквивалентов, который напрямую связан с другими фундаментальными законами - законом сохранения массы и правилом кратных отношений.
Различные химические вещества могут взаимодействовать не произвольно, а в строго определенных пропорциях. Поэтому в химическом лексиконе появились слово «эквивалентность». Новое понятие в переводе на русский язык означало «равноценность».
Слайд 16Закон эквивалентов в химии несколько раз менял свою формулировку.
Эквивалент (Э) – реальная

или условная частица вещества, которая может присоединить, заместить в кислотно-основных реакциях один ион водорода (или другого одновалентного элемента), а в окислительно-восстановительных реакциях – присоединить или высвободить один электрон.
Эквивалент (Э) – такое количество вещества, которое соединяется с 1 моль атомов водорода или замещает его в соединениях.
Под условной частицей вещества подразумевается реально существующие частицы (молекулы, ионы, электроны и т.д.), доли этих частиц (например, 1/2 иона) или их группы.
Слайд 17Фактор эквивалентности fэ (х) – число, обозначающее, какая доля реальной частицы вещества

X эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону в реакции окисления-восстановления, а также число моль вещества, соединяющегося с 1 моль водорода.
Фактор эквивалентности – величина безразмерная. Принимает значения 1 или меньше единицы.
Для простых веществ и элементов в соединении
где В – валентность элемента.
Например, для водорода или натрия fэ= 1/1 = 1. Для магния или кислорода fэ = 1/2.
Слайд 19Для сложных веществ фактор эквивалентности определяется следующим образом:
Например, в соединениях HCl, H2S,

NH3, CH4 фактор эквивалентности хлора, серы, азота, углерода
равен соответственно 1 1/2, 1/3, 1/4.
Слайд 20Молярная масса эквивалента вещества (эквивалентная масса) Мэ(х) – масса одного моля эквивалента

этого вещества, равная произведению фактора эквивалентности fэ(х) на молярную массу вещества Мх.
Мэ(х) = fэ (х) · Мх (кг/моль, г/моль).
Если одно из реагирующих веществ – газ, то для него вводится понятие эквивалентного объема вещества – Vэ(х), который рассчитывается на основании следствия из закона Авогадро:
1 моль газа массой М занимает объем 22,4 л, при нормальных условиях (н.у.): Рo =101,3 кПа; То = 273 К
Например, при нормальных условиях 1 моль эквивалента водорода занимает объем, равный:
Vэ (Н2) = 22,4 · 1 / 2 = 11,2 л/моль.
Для кислорода эта величина составляет
Vэ (О2) = 22,4 · 8 / 32 = 5,6 л/моль.
Слайд 21Закон эквивалентов: массы (или объемы) реагирующих веществ, прямо пропорциональны эквивалентным массам (или

эквивалентным объемам) этих веществ.
Если одно из этих веществ представляет собой газ, то закон эквивалентов записывается в виде:
Открыт закон был немецким химиком И. В. Рихтером, труды которого долгое время были неизвестны. В своей трехтомной работе, опубликованной в период с 1792 по 1794 годы под названием «Начала стехиометрии, или способ измерения химических элементов», ученый показал, что химические вещества вступают в реакции в строгом соотношении.
Слайд 22 Пример 1. Рассчитайте эквивалентную массу трёхвалентного металла, навеска которого массой 1,44 г

при его полном окислении превращается в 2,72 г соответствующего оксида. Какой металл используется в качестве исходного реагента?
Слайд 23Пример 2. Сколько граммов цинка растворилось в соляной кислоте, если известно, что

в ходе этой реакции выделилось 1,2 л водорода.
Слайд 24ЗАКОН АВОГАДРО
Формулировка закона:
В равных объемах различных газов при одинаковых внешних

условиях
(температура и давление) содержится одинаковое число молекул
1следствие:
1 моль любого газа при постоянных условиях занимает один и тот же объем (молярный объем)




























 Презентация на тему Щелочные металлы
Презентация на тему Щелочные металлы  Классификация химических реакций
Классификация химических реакций Презентация на тему Уголь
Презентация на тему Уголь  Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В.
Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В. Типы кристаллических решеток
Типы кристаллических решеток Химия нефти и газа
Химия нефти и газа Оксиды неметаллов и металлов. Состав и названия
Оксиды неметаллов и металлов. Состав и названия Знаки химических элементов. 8 класс
Знаки химических элементов. 8 класс Твердые электролиты
Твердые электролиты Метод нейтрализации
Метод нейтрализации Известная и неизвестная вода
Известная и неизвестная вода Золото. Физические свойства золота
Золото. Физические свойства золота Кислородные соединения углерода
Кислородные соединения углерода Презентация на тему Спирты 10 класс
Презентация на тему Спирты 10 класс  Использование комбинаторных задач для подсчета вероятностей
Использование комбинаторных задач для подсчета вероятностей Химические методы анализа. Аналитические методы контроля в техносферной безопасности. Лекция 6
Химические методы анализа. Аналитические методы контроля в техносферной безопасности. Лекция 6 Способы разделение смесей. 7 класс
Способы разделение смесей. 7 класс Мемо-химия. Защита проекта
Мемо-химия. Защита проекта Алкены
Алкены Аммиак. Состав. Строение. Химическая ковалентная полярная связь. Кристаллическая молекулярная решетка
Аммиак. Состав. Строение. Химическая ковалентная полярная связь. Кристаллическая молекулярная решетка Празеодим
Празеодим Металлы
Металлы Prezentatsia1_1
Prezentatsia1_1 Виды химической связи
Виды химической связи Классификация ХГ методов разделения
Классификация ХГ методов разделения Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс Презентация на тему Лайнус Полинг
Презентация на тему Лайнус Полинг  Дисперсные системы. Гели
Дисперсные системы. Гели