Слайд 2РЕАКЦИИ ИОННОГО ОБМЕНА
Уравнения ионных рекций моржно записать в полном и сокращённом виде.

Слайд 3 СОКРАЩЁННОЕ УРАНЕНИЕ ПОКАЗЫВАЕТ КАКИЕ ИМЕННО ИОНЫ УЧАСТВУЮТ В РЕАКЦИИ.

Слайд 6Если в составе соли имеются ионы, которые могут связываться с ионами Н+

или ионами ОН-, то соли будут реагировать с водой.
Процесс взаимодействия солей с водой называется ГИДРОЛИЗОМ («гидро»- вода, «лизис»- разложение.
Гидролиз –это взаимодействие ионов соли с водой с обра
зованием малодиссоциирующих электролитов.
Слайд 7С водой реагируют соли, образованные или слабым основанием и сильной кислотой, или

сильным основанием и слабой кислотой.
Соли образованные сильным основанием и сильной кислотой не реагируют с водой.
Слайд 8ГИДРОЛИЗ СОЛЕЙ.
Гидролиз не возможен
Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl, NaNO3), гидролизу

подвергаться не будет, так как в этом случае слабый электролит не образуется.
рН таких растворов = 7. Реакция среды остается нейтральной.
Слайд 93). Гидролиз по аниону (в реакцию с водой вступает только анион)
Соль, образованная сильным

основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид-ион ОН- и другие ионы.
K2SiO3 + НОH <=>KHSiO3 + KОН
2K+ +SiO32- + Н+ + ОH-<=> НSiO3- + 2K+ + ОН-
рН таких растворов > 7 (раствор приобретает щелочную реакцию).
Слайд 10Совместный гидролиз (в реакцию с водой вступает и катион и анион)
Соль, образованная

слабым основанием и слабой кислотой (СН3СООNН4, (NН4)2СО3, Al2S3), гидролизуется и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива.
Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной:
Al2S3 + 6H2O =>2Al(OH)3↓+ 3H2S↑
Гидролиз - процесс обратимый.
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота
Слайд 15Рассмотрим на примере гидролиза сульфита натрия (Na2SO3) – двухосновной соли, образованной слабой

кислотой – сернистой (H2SO3) и сильным основанием – гидроксидом натрия (NaOH):
Na2SO3 ↔ SO32- + 2Na+ (диссоциация соли);
SO32- + 2Na++ H2O ↔ HSO3—+ OH— + 2Na+ (полное ионное уравнение);
SO32- + H2O ↔ HSO3—+ OH— (сокращенное ионное уравнение);
Na2SO3 + H2O ↔ NaHSO3+ NaOH (молекулярное уравнение
Слайд 16Теоретически возможна вторая ступень гидролиза:
NaHSO3↔Na+ + HSO3—(диссоциация соли);
Na+ + HSO3— + H2O

↔H2SO3 + OH— + Na+ (полное ионное уравнение);
HSO3— + H2O ↔ H2SO3 + OH—(сокращенное ионное уравнение);
NaHSO3+ H2O↔H2SO3 +NaOH (молекулярное уравнение).
Присутствие гидроксид-ионов свидетельствует о том, что реакция среды водного раствора сульфита натрия будет щелочной, а окраска индикатора лакмуса – синей.















 Презентация на тему Волокна
Презентация на тему Волокна  Терпеноиды. Эфирные масла
Терпеноиды. Эфирные масла Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік
Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік Углеводы
Углеводы Основные понятия и законы химии
Основные понятия и законы химии Углеводороды (УВ)
Углеводороды (УВ) Вещества простые и сложные
Вещества простые и сложные Радиоактивные изотопы
Радиоактивные изотопы Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9
Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9 Номенклатура и изомерия карбоновых кислот
Номенклатура и изомерия карбоновых кислот Соединения серы. Сернистая и серная кислоты
Соединения серы. Сернистая и серная кислоты Осмотическое давление
Осмотическое давление Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями)
Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями) Презентация на тему Неметаллы, особенности строения
Презентация на тему Неметаллы, особенности строения 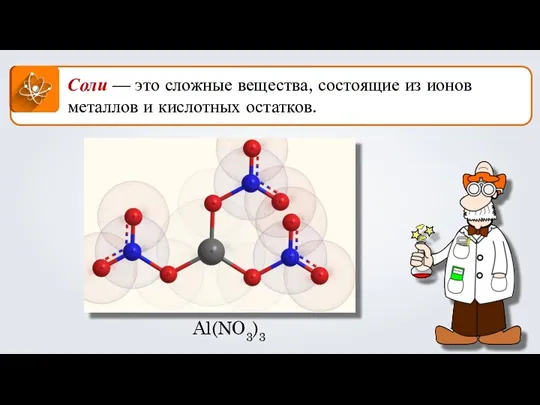 Соли. Формула соли
Соли. Формула соли Презентация на тему Альдегиды
Презентация на тему Альдегиды  Интересные свойства пластика
Интересные свойства пластика Золоторудное поле Дуэт
Золоторудное поле Дуэт Кислоты. Презентация к уроку химии в 8 классе
Кислоты. Презентация к уроку химии в 8 классе Алкины. Номенклатура алкинов
Алкины. Номенклатура алкинов Потенциометрический анализ, титрование
Потенциометрический анализ, титрование Органическая химия
Органическая химия Валентность
Валентность Теория электролитической диссоциации. Ионные уравнения. Задания
Теория электролитической диссоциации. Ионные уравнения. Задания Разбор контрольной работы. Химия (9 класс)
Разбор контрольной работы. Химия (9 класс) Структура и свойства чистого титана
Структура и свойства чистого титана Путешествие в мир кислот
Путешествие в мир кислот Хим-1 презент
Хим-1 презент