Содержание
- 2. Периодическая система Менделеева
- 3. Положения металлов в П.С. Каждый период, кроме первого, начинается с активного элемента –металла . Эти элементы
- 4. Семь металлов древности соотносили с семью известными металлами
- 5. Часы истории человечества стали отсчитывать время быстрее, когда в его жизнь вошли их металлы и их
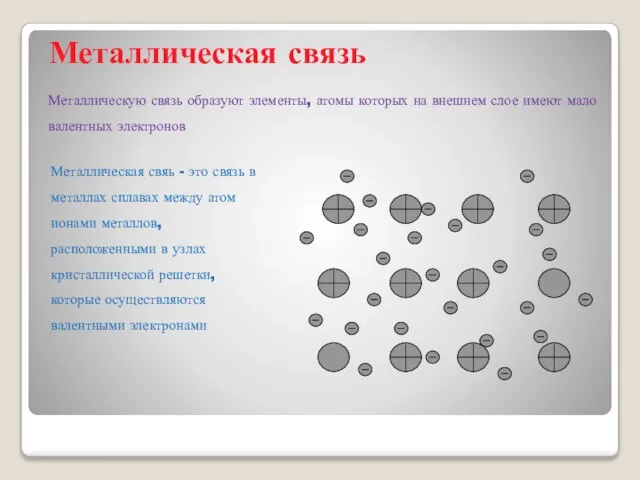
- 6. Металлическая связь Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов Металлическая
- 7. Металлы - это химические элементы, атомы которых отдают электроны внешнего электронного слоя, превращаясь в положительные ионы
- 8. Физические свойства
- 9. Все металлы делятся на две большие группы: Черные металлы Цветные металлы Имеют темно-серый цвет, большую плотность,
- 10. В зависимости от своей плотности металлы делятся на: Легкие (плотность не более 5 г/см ) Тяжелые
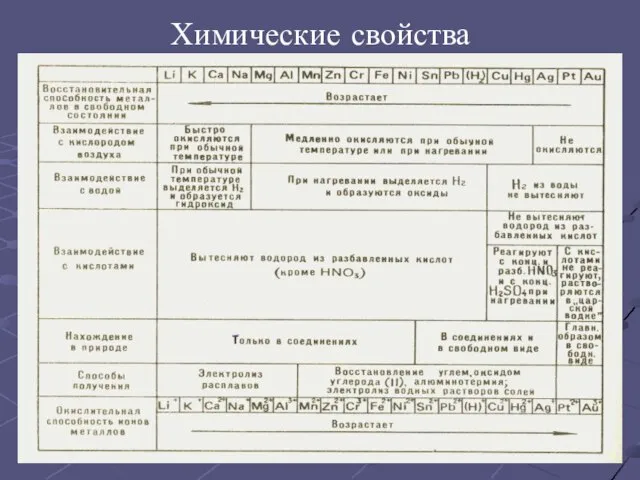
- 11. Химические свойства
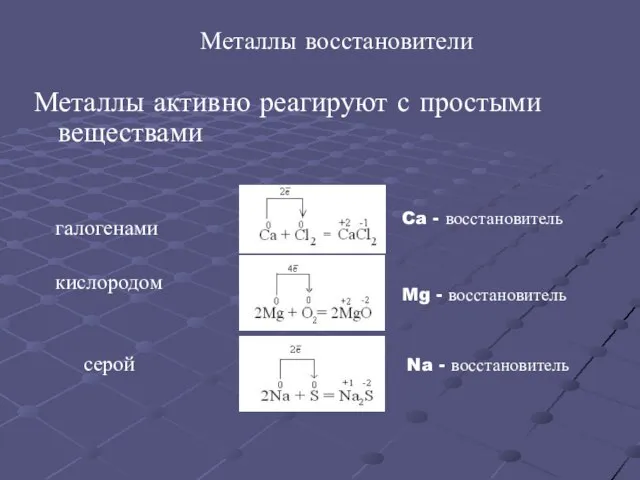
- 12. Металлы восстановители Металлы активно реагируют с простыми веществами галогенами кислородом серой Ca - восстановитель Mg -
- 13. (продолжение) Металлы реагируют с сложными веществам : водою: кислотами: растворами солей:
- 14. Электрохимический ряд напряжений металлов Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из растворов кислот,
- 15. Коррозия металлов Коррозия –это процесс самопроизвольного разрушения металлов и сплавов под влиянием внешней среды (от латинского-corrosio
- 16. Способы защиты от коррозии Шлифование поверхностей изделия 2. Применение легированных сплавов (общеизвестны легированные стали – «нержавейки»
- 17. Влияние недостатка и избытка ионов металлов на состояние растений и животных
- 18. Царь – пушка (бронза)
- 19. Бронзовый экипаж
- 20. Царь-колокол (бронза)
- 22. Скачать презентацию
















 Азот
Азот Презентация по Химии "Группа веществ, изолируемых из биологического материала экстракцией и сорбцией"
Презентация по Химии "Группа веществ, изолируемых из биологического материала экстракцией и сорбцией"  Типы кристаллических решеток
Типы кристаллических решеток Калийные удобрения
Калийные удобрения Презентация на тему Обобщение знание и умений и предельных и непредельных углеводородах
Презентация на тему Обобщение знание и умений и предельных и непредельных углеводородах  Создание учебно-методических материалов по химии в современной форме (презентации уроков)
Создание учебно-методических материалов по химии в современной форме (презентации уроков) Средства ухода за кожей
Средства ухода за кожей Химическая организация клетки. Неорганические вещества
Химическая организация клетки. Неорганические вещества Галогены
Галогены Амфотерные гидроксиды
Амфотерные гидроксиды Неметаллы – химические элементы
Неметаллы – химические элементы Расчеты по химическим уравнениям реакций
Расчеты по химическим уравнениям реакций Скорость химической реакции. 9 класс
Скорость химической реакции. 9 класс Подготовка выпускников к ГИА по химии: опыт, проблемы, перспективы
Подготовка выпускников к ГИА по химии: опыт, проблемы, перспективы Презентация на тему Свойства простых веществ
Презентация на тему Свойства простых веществ  Презентация на тему Фосфор 9 класс
Презентация на тему Фосфор 9 класс  Алкены
Алкены Химия и автомобиль
Химия и автомобиль Презентация на тему Валентные состояния атома углерода
Презентация на тему Валентные состояния атома углерода  Реакции неполного окисления в органике
Реакции неполного окисления в органике Типы химических связей
Типы химических связей Электрохимия. Решение задач. ИДЗ 4
Электрохимия. Решение задач. ИДЗ 4 Коррозия металлов и ГЭ
Коррозия металлов и ГЭ Диссоциация. Уравнения диссоциации
Диссоциация. Уравнения диссоциации Lektsia_4_Tochechnye_gruppy_simmetrii_Simvoly_Shenflisa
Lektsia_4_Tochechnye_gruppy_simmetrii_Simvoly_Shenflisa Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Кроссворд Интересные факты в химии
Кроссворд Интересные факты в химии Водород – топливо будущего
Водород – топливо будущего