Содержание
- 4. 460-370 до н.э. Слово «Атом» происходит от древнегреческого «ἄτομος» и переводится как «неделимый». Школа атомистов, Демокрит.
- 5. В 1897 г. Дж. Томсон экспериментально доказал, что атомы любого вещества содержат идентичные друг другу отрицательно
- 6. В 1916-1925 гг. А. Зоммерфельд и ряд других ученых описали многоэлектронные атомы с позиции теории Н.
- 7. Дальнейшее развитие теория строения атома получила благодаря: релятивистской механике, описывающей движение частиц со скоростями, близкими к
- 8. В начале XX века, результаты исследований фотоэффекта, особенностей распределения энергии в оптических спектрах (атомные спектры состоят
- 9. Одним из фундаментальных положений квантовой механики является принцип неопределенности, сформулированный немецким физиком Вернером Гейзенбергом в 1927
- 10. Точное нахождение частицы (электрона) заменяется понятием статистической вероятности нахождения ее в определенном объеме (околоядерного) пространства. Движение
- 11. Определяемое Ψ распределение вероятности пребывания электрона в околоядерном пространстве называется атомной орбиталью (АО). Величина АО такова,
- 12. Атом - сложная электромагнитная микросистема, являющаяся носителем свойств химического элемента. Каждому химическому элементу соответствует совокупность определенных
- 13. Атомная единица массы (а.е.м.) – внесистемная единица, применяемая для описания относительных масс молекул, атомов, атомных ядер
- 14. Молекула (уменьшительное от лат. moles – масса) – это наименьшая частица вещества, определяющая его свойства. Состоит
- 15. Современная формулировка Периодического закона: Строение и свойства элементов и их соединений находятся в периодической зависимости от
- 18. Период – последовательный горизонтальный ряд элементов, размещенных в порядке возрастания заряда ядра атомов. Период начинается ns1
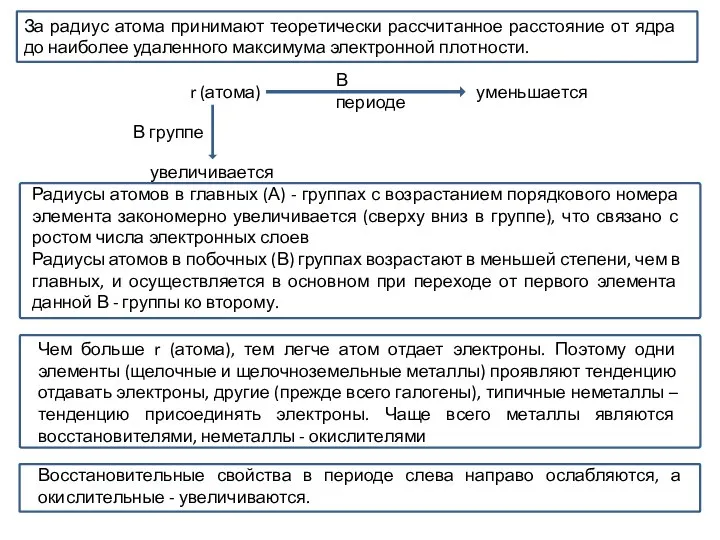
- 19. За радиус атома принимают теоретически рассчитанное расстояние от ядра до наиболее удаленного максимума электронной плотности. r
- 20. Минимальная энергия, необходимая для отрыва наиболее слабо связанного электрона от невозбужденного атома, называется энергией ионизации (ЭИ).
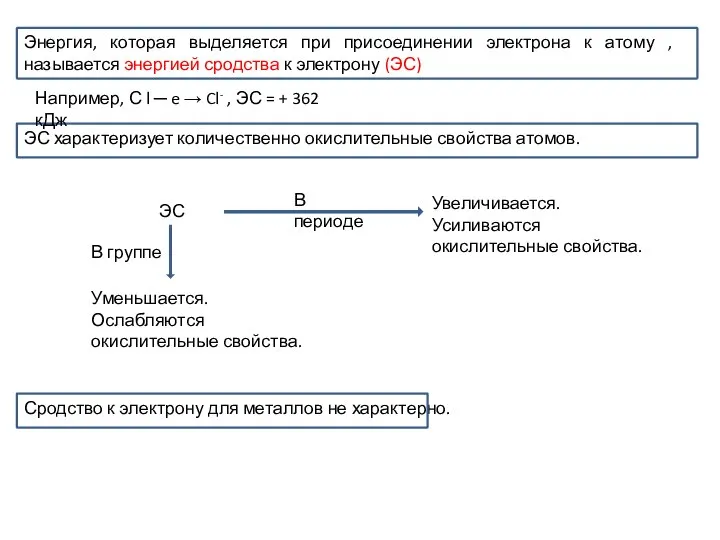
- 21. Энергия, которая выделяется при присоединении электрона к атому , называется энергией сродства к электрону (ЭС) ЭС
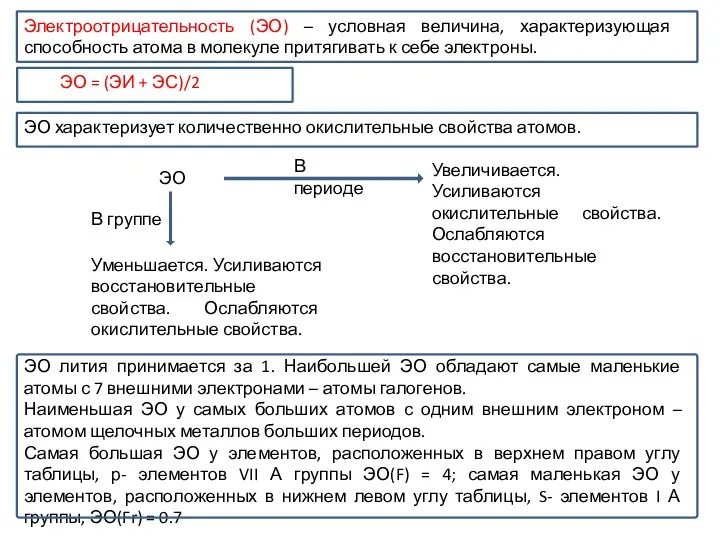
- 22. Электроотрицательность (ЭО) – условная величина, характеризующая способность атома в молекуле притягивать к себе электроны. ЭО Увеличивается.
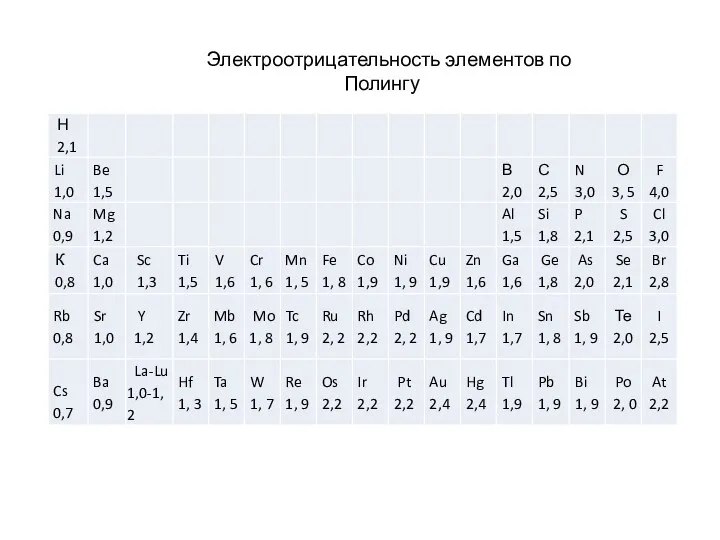
- 23. Электроотрицательность элементов по Полингу
- 24. Изменение кислотно-основных свойств особенно четко проявляется у элементов 3-го периода. Это видно из ряда их гидроксидов,
- 25. Для характеристики поведения электрона в атоме в соответствии с уравнением Шредингера введены квантовые числа. Для описания
- 26. Магнитное квантовое число ml - характеризует пространственную ориентацию электронных облаков. Оно принимает любое целое значение от
- 27. Формы электронных облаков вероятности различных атомных орбиталей
- 28. Спиновое квантовое число ms - характеризует вращение электрона вокруг собственной оси (спин), проекция вектора собственного момента
- 29. Электрон, который последним заполняет орбитали атома элемента называют формирующим. В периодической системе элементов различают 4 группы
- 31. Блоки таблицы включают элементы, у которых формируется один тип орбиталей (подуровень): s- блок (s- элементы) -
- 32. Принцип Паули. В атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
- 33. Принцип наименьшей энергии. Электроны в атоме занимают наиболее низкое энергетическое состояние, отвечающее наиболее устойчивому его состоянию.
- 34. Алгоритм составления электронной конфигурации атома: 1. По координатам или порядковому номеру устанавливают положение элемента в таблице
- 35. При составлении краткой электронной конфигурации невалентные электроны заменяют символом благородного газа (полный октет электронов ns2np6), которым
- 36. Экспериментально установлено, что для ряда d и f –элементов, в частности с d5 и d10 конфигурации
- 37. Алгоритм описания квантовых чисел Li…[He] 2s1. 2-й период – главное квантовое число n=2. Литий – s-
- 38. As…[Ar, 3d10] 4s24p3. 4-й период – главное квантовое число n=4. Мышьяк – p- элемент, то есть
- 39. При сообщении атому энергии (в результате столкновения с другим атомом, поглощения кванта света, электронного удара) один
- 41. Валентная конфигурация или сокращенная электронная формула -содержит только валентные электроны (наиболее активные, которые могут участвовать в
- 42. Марганец Мn … 3d54s2 квантовые числа для формирующего электрона 3d: n = 3, l = 2,
- 44. Скачать презентацию
Слайд 4460-370 до н.э. Слово «Атом» происходит от древнегреческого «ἄτομος» и переводится как
460-370 до н.э. Слово «Атом» происходит от древнегреческого «ἄτομος» и переводится как

1743-1744 гг. М.В. Ломоносов, - попытка согласовать разрабатываемое им корпускулярное (атомно-молекулярное) учение с химией
1802 г. Джон Дальтон, «Атомы — химические элементы, которые нельзя создать заново, разделить на более мелкие частицы, уничтожить путем каких-либо химических превращений. Любая химическая реакция просто изменяет порядок группировки атомов». Ввёл понятие «атомный вес», рассчитал атомные веса (массы) нескольких элементов и составил первую таблицу их относительных атомных весов.
1869 год Д.И. Менделеев представил открытый им Периодический закон химических элементов. Окончательно Периодический закон был сформулирован в 1871 году: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
С середины 1880-х Периодический закон окончательно признан фундаментальным законом природы мировым научным сообществом после открытия предсказанных Д.И. Менделеевым элементов.
В конце XIX века - экспериментально опровергнута «неделимость» атома. А. Беккерель в 1896 г. обнаружил самопроизвольное испускание урановыми рудами ранее неизвестного вида излучения, проникающего через вещества. В 1898 г. то же явление было обнаружено и Пьером Кюри и Марией Склодовской-Кюри, которые доказали, что в процессе распада урана образуются два новых элемента – полоний и радий.
Слайд 5В 1897 г. Дж. Томсон экспериментально доказал, что атомы любого вещества содержат

1900 г. М.Планк. Предложена теория, согласно которой переход электрона из одного энергетического состояния в другое осуществляется испусканием или поглощением энергии в виде отдельных порций – квантов: E = hν.
В 1905 г. Альберт Эйнштейн предложил рассматривать свет не только как электромагнитную волну с энергией E = h·υ, но и одновременно как поток фотонов, движущихся со скоростью света (с) и обладающих массой mf. Энергия фотонов может быть вычислена из соотношения E = mf·c2
1911 г. Э. Резерфорд. Экспериментально установлено существование ядра атома. По теории Резерфорда: в центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома; весь положительный заряд и почти вся масса атома сосредоточены в его ядра; вокруг ядра вращаются электроны. Их число равно положительному заряду ядра. 1911 г. экспериментально установлено существование протона. Впервые возникла ядерная (планетарная) модель атома.
1913 г. Н.Бор. Предложена модель, согласующая планетарную модель строения атома и квантовый закон М. Планка. Согласно Н. Бору, атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определенная энергия E.
Слайд 6В 1916-1925 гг. А. Зоммерфельд и ряд других ученых описали многоэлектронные атомы

Планетарные модели атома Э. Резерфорда, Н. Бора, А. Зоммерфельда позволили описать качественную картину строения электронных оболочек атомов элементов, количественно рассчитать энергию электрона в атоме водорода, объяснить эффект расщепления спектральных линий атомов в магнитном и электрическом поле. Однако, попытки описать поведение микроскопических объектов, движущихся со скоростями, близкими к скорости света с точки зрения классической механики и электродинамики, привели к неустранимым противоречиям.
Слайд 7Дальнейшее развитие теория строения атома получила благодаря: релятивистской механике, описывающей движение частиц
Дальнейшее развитие теория строения атома получила благодаря: релятивистской механике, описывающей движение частиц

Слайд 8В начале XX века, результаты исследований фотоэффекта, особенностей распределения энергии в оптических
В начале XX века, результаты исследований фотоэффекта, особенностей распределения энергии в оптических

В 1905 г. Альберт Эйнштейн предложил рассматривать свет не только как электромагнитную волну с энергией E = h·υ, но и одновременно как поток фотонов, движущихся со скоростью света (с) и обладающих массой mf. Энергия фотонов может быть вычислена из соотношения E = mf·c2. Отличие фотонов от макрочастиц заключается в том, что они не имеют массы покоя и существуют только при движении со скоростью света.
В 1924 году французский физик Луи де Бройль перенес представления о двойственной природе электромагнитного излучения на микрочастицы вещества с массой покоя, не равной нулю, в том числе и на электрон и предложил уравнение, связывающее длину волны λ электрона или другой частицы с массой m и скоростью υ:
где m и v – масса и скорость частицы, h – постоянная Планка, равная 6,626·10–34 Дж·с.
1932 г. Дж. Чедвик. Открытие нейтрона.
Слайд 9Одним из фундаментальных положений квантовой механики является принцип неопределенности, сформулированный немецким физиком
Одним из фундаментальных положений квантовой механики является принцип неопределенности, сформулированный немецким физиком

При достаточно точной фиксации положения частицы x погрешность (неопределенность) Δрх в определении импульса оказывается несоизмеримо большой относительно значения самого импульса, что приводит фактически к потере информации об импульсе частицы. Также, из принципа неопределенности следует, что чем точнее вычислен импульс или скорость, тем неопределеннее становится координата электрона в атоме. В квантовой механике классическое понятие точной координаты (траектории, орбиты) заменяется понятием статистической вероятности нахождения электрона в области объема ΔV вокруг ядра атома.
Слайд 10 Точное нахождение частицы (электрона) заменяется понятием статистической вероятности нахождения ее в определенном
Точное нахождение частицы (электрона) заменяется понятием статистической вероятности нахождения ее в определенном

В 1926 г. австрийский ученый Эрвин Шредингер предположил, что, электроны и другие микрочастицы ведут себя подобно волнам на поверхности океана. С течением времени пик волны (соответствующий месту, в котором, скорее всего, будет находиться электрон) смещается в пространстве в соответствии с описывающим эту волну уравнением.
Для описания пространственных характеристик электрона в атоме вводят понятие волновой функции Ψ. |Ψ|2dv - плотность вероятности нахождения е- в определенном объеме околоядерного пространства.
E–полная энергия частицы с координатами x,y,z; U–потенциальная энергия частицы (x,y,z); Ψ–волновая функция, описывающая волны вероятности.
Квантовая механика. Поведение движущихся микрообъектов (в том числе и электронов) – это одновременное проявление, как свойств частиц, так и свойств волн, т.н. двойственная (корпускулярно- волновая) природа.
Слайд 11Определяемое Ψ распределение вероятности пребывания электрона в околоядерном пространстве называется атомной орбиталью
Определяемое Ψ распределение вероятности пребывания электрона в околоядерном пространстве называется атомной орбиталью

Поскольку электрон несет отрицательный заряд, его орбиталь представляет собой определенное распределение заряда, которое получило название электронного облака.
Для характеристики атомной орбитали, в соответствии с уравнением Шредингера введены квантовые числа: главное (n), орбитальное (l) и магнитное (ml).
Экспериментально установлено, что электрон имеет еще одно фундаментальное свойство, называемое спином. В 1926 г. Уленбек и Голдсмит показали, что помимо орбитального движения электрон должен участвовать во вращении вокруг собственной оси, проходящей через центр. Поэтому электрон должен иметь собственный момент импульса, а так как он является заряженной частицей, то и магнитный момент.
Проекция вектора собственного момента импульса электрона в магнитном поле может иметь только два значения: и (знаки «плюс» и «минус» соответствуют различным направлениям проекции вектора импульса).
Для характеристики электрона на данной атомной орбитали введено спиновое квантовой число (ms), не являющееся решением уравнения Шредингера.
Слайд 12Атом - сложная электромагнитная микросистема, являющаяся носителем свойств химического элемента. Каждому химическому
Атом - сложная электромагнитная микросистема, являющаяся носителем свойств химического элемента. Каждому химическому

Атом можно представить, как положительно заряженное ядро, окруженное электронным облаком. В ядре сосредоточено более 99,9% массы атома, при этом его размер более чем в 10 тысяч раз меньше размера атома. В состав ядра входят нуклоны – положительно заряженные протоны и нейтральные нейтроны.
Электро́н (от др.-греч. ἤλεκτρον — янтарь) — стабильная отрицательно заряженная элементарная частица, носитель наименьшей массы 0,91095·10–31 кг и наименьшего электрического заряда 1,6021·10–19 Кл. Число электронов в атоме равно числу протонов в ядре, то есть атом электрически нейтрален.
Прото́н (от др.-греч. πρῶτος — первый, основной) — элементарная частица, имеющая положительный электрический заряд и входящая в состав ядра каждого атома. Масса протона равна 1,6721·10–27 кг, что в 1836 раз больше массы электрона. Электрический заряд равен 1,66·10-19 Кл.
Нейтро́н (от лат. neuter — ни тот, ни другой) — тяжёлая элементарная частица, не имеющая электрического заряда, с массой 1,6749·10–27кг, в 1839 раз больше массы электрона. Нейтрон в свободном состоянии – нестабильная частица, он самостоятельно превращается в протон с испусканием электрона и антинейтрино. Ядра всех атомов имеют нейтроны, за исключением первого изотопа водорода (протия).
Слайд 13Атомная единица массы (а.е.м.) – внесистемная единица, применяемая для описания относительных масс
Атомная единица массы (а.е.м.) – внесистемная единица, применяемая для описания относительных масс

Атомной массой называется сумма масс всех протонов, нейтронов и электронов, из которых состоит тот или иной атом или молекула. По сравнению с протонами и нейтронами масса электронов очень мала, поэтому ее, как правило, не учитывают в расчетах. Атомную массу (А) рассчитывают как сумму числа протонов (Z) и нейтронов (N): А = Z + N.
Атомный вес – это среднее значение атомных масс всех изотопов элемента, встречающихся в природе, с учетом их распространения.
Нуклиды (лат. nucleus – ядро) – общее название атомных ядер, характеризуются определенным числом протонов и нейтронов (величиной положительного заряда и массовым числом).
Изотопы (греч. ισοζ – одинаковый + τοποζ – место) – ядра атома химического элемента, имеющие одинаковое число протонов, но различающиеся числом нейтронов, а соответственно массовыми числами. Например, нуклидами водорода являются изотопы: протий 1H (Z=1, N=0, а.е.м.=1,008), дейтерий 2H (Z=1, N=1, а.е.м.=2,014), тритий 3H (Z=1, N=2, а.е.м. = 3,016) и еще 4 изотопа, с увеличивающимся числом протонов.
Для описания массы и заряда электронов и нуклонов часто используют не абсолютные, а относительные величины
Слайд 14Молекула (уменьшительное от лат. moles – масса) – это наименьшая частица вещества,
Молекула (уменьшительное от лат. moles – масса) – это наименьшая частица вещества,

Молекулярная масса – масса молекулы. Молекулярная масса, выраженная в атомных единицах массы, равна относительной молекулярной массе и молярной массе (г/моль), но равна лишь численно, различаясь по размерности.
Ионы (греч. ιον – идущий) – электрически заряженные частицы, образовавшиеся из электронейтральных атомов (или групп атомов) в результате присоединения или потери электронов. Положительно заряженные ионы называются катионами (греч. κατα – «вниз+ион»), отрицательно заряженные – анионами (греч. ανα – «вверх+ион»).
Радикалы (лат. radicalis – коренной) – частицы (атомы или группы атомов) с неспаренными электронами.
Слайд 15Современная формулировка Периодического закона:
Строение и свойства элементов и их соединений находятся в
Современная формулировка Периодического закона:
Строение и свойства элементов и их соединений находятся в

Физический смысл периодического закона:
Элементы располагаются в периодической системе в порядке возрастания заряда их ядер.
Вследствие периодически повторяющейся валентной конфигурации атомов элементов происходит периодическое изменение физико-химических свойств этих элементов.
Периодически изменяются: атомные и ионные радиусы, потенциалы ионизации и сродства к электрону, электроотрицательность, валентные, оптические и магнитные свойства элементов и кислотно-основные свойства соединений.
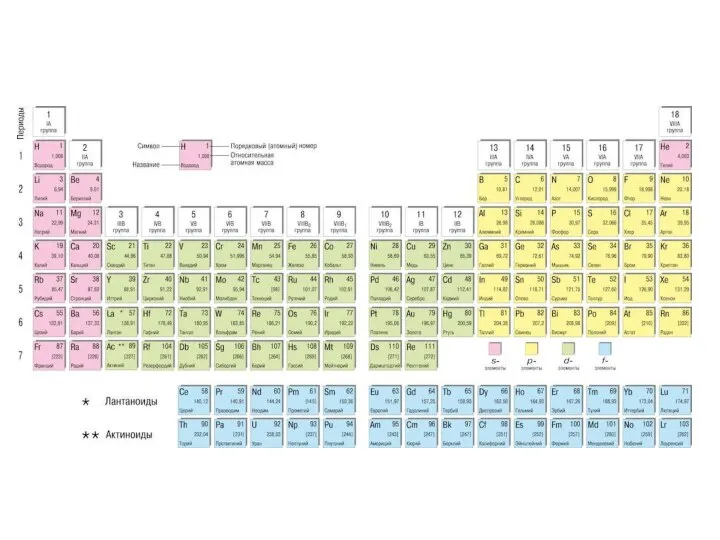
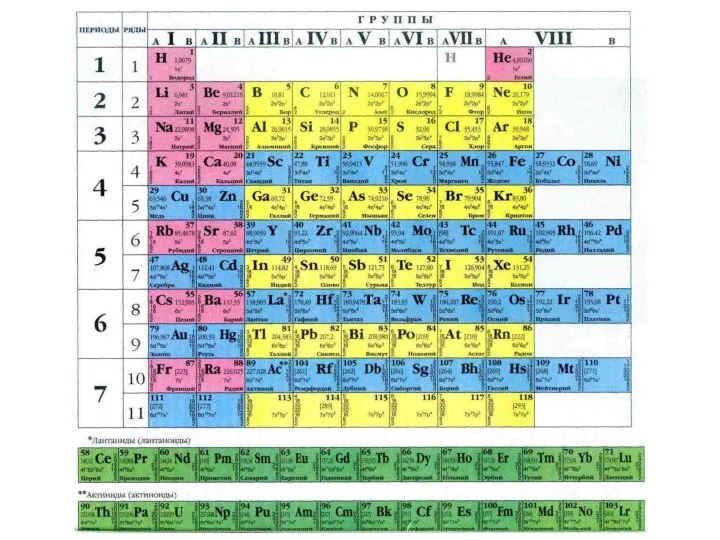
Слайд 18Период – последовательный горизонтальный ряд элементов, размещенных в порядке возрастания заряда ядра
Период – последовательный горизонтальный ряд элементов, размещенных в порядке возрастания заряда ядра

Группа (последовательный вертикальный ряд) – совокупность элементов, атомы которых имеют одинаковое число электронов на внешнем уровне и незавершенном предвнешнем (внешнем) подуровне, т.е. могут проявлять одинаковую валентность. Для большинства элементов номер группы показывает максимальную валентность.
Группы делятся на главные и побочные подгруппы. К главным подгруппам относятся s и p элементы, к побочным подгруппам – d и f элементы.
В информация об элементе:
- символ элемента,
- название элемента,
порядковый номер элемента, совпадающий
с зарядом ядра и числом электронов,
- относительная атомная масса,
- распределение электронов по уровням,
- конфигурация валентных электронов.
Относительный
атомный вес
Слайд 19За радиус атома принимают теоретически рассчитанное расстояние от ядра до наиболее удаленного
За радиус атома принимают теоретически рассчитанное расстояние от ядра до наиболее удаленного
r (атома)
уменьшается
увеличивается
В периоде
В группе
Радиусы атомов в главных (А) - группах с возрастанием порядкового номера элемента закономерно увеличивается (сверху вниз в группе), что связано с ростом числа электронных слоев
Радиусы атомов в побочных (В) группах возрастают в меньшей степени, чем в главных, и осуществляется в основном при переходе от первого элемента данной В - группы ко второму.
Чем больше r (атома), тем легче атом отдает электроны. Поэтому одни элементы (щелочные и щелочноземельные металлы) проявляют тенденцию отдавать электроны, другие (прежде всего галогены), типичные неметаллы – тенденцию присоединять электроны. Чаще всего металлы являются восстановителями, неметаллы - окислителями
Восстановительные свойства в периоде слева направо ослабляются, а окислительные - увеличиваются.
Слайд 20Минимальная энергия, необходимая для отрыва наиболее слабо связанного электрона от невозбужденного атома,
Минимальная энергия, необходимая для отрыва наиболее слабо связанного электрона от невозбужденного атома,

ЭИ
Увеличивается. Ослабляются восстановительные свойства.
Уменьшается. Усиливаются восстановительные свойства.
В периоде
В группе
ЭИ количественно характеризует энергию связи электрона в атоме. Энергия ионизации является мерой восстановительных свойств. Чем меньше ЭИ, тем больше восстановительная способность элемента, тем он более выраженный металл.
В побочных (В)-группах (кроме III В группы) восстановительные свойства усиливаются снизу вверх.
Например, Na ─ e → Na+ , ЭИ = ─ 490 кДж
Слайд 21Энергия, которая выделяется при присоединении электрона к атому , называется энергией сродства
Энергия, которая выделяется при присоединении электрона к атому , называется энергией сродства
ЭС
Увеличивается. Усиливаются окислительные свойства.
Уменьшается. Ослабляются окислительные свойства.
В периоде
В группе
ЭС характеризует количественно окислительные свойства атомов.
Сродство к электрону для металлов не характерно.
Например, С l ─ e → Cl- , ЭС = + 362 кДж
Слайд 22Электроотрицательность (ЭО) – условная величина, характеризующая способность атома в молекуле притягивать к
Электроотрицательность (ЭО) – условная величина, характеризующая способность атома в молекуле притягивать к
ЭО
Увеличивается. Усиливаются окислительные свойства. Ослабляются восстановительные свойства.
Уменьшается. Усиливаются восстановительные свойства. Ослабляются окислительные свойства.
В периоде
В группе
ЭО характеризует количественно окислительные свойства атомов.
ЭО лития принимается за 1. Наибольшей ЭО обладают самые маленькие атомы с 7 внешними электронами – атомы галогенов.
Наименьшая ЭО у самых больших атомов с одним внешним электроном – атомом щелочных металлов больших периодов.
Самая большая ЭО у элементов, расположенных в верхнем правом углу таблицы, р- элементов VII А группы ЭО(F) = 4; самая маленькая ЭО у элементов, расположенных в нижнем левом углу таблицы, S- элементов I А группы, ЭО(Fr) = 0.7
ЭО = (ЭИ + ЭС)/2
Слайд 23Электроотрицательность элементов по Полингу
Электроотрицательность элементов по Полингу
Слайд 24Изменение кислотно-основных свойств особенно четко проявляется у элементов 3-го периода.
Это видно
Изменение кислотно-основных свойств особенно четко проявляется у элементов 3-го периода.
Это видно

NaOH; Mg(OH)2 Al(OH)3 H2SiO3; H3PO4 H2SO4; HClO4
основания амфотерные св-ва слабые к-ты сильные к-ты
Усиливаются кислотные свойства
Усиливаются основные свойства
В периоде
В группе
Эта периодическая закономерность в целом сохраняется и для больших периодов, но для них характер изменения свойств повторяется дважды: От I А - группы к VII В –группе и от I В - группы к VII А- группе
Кислотно-основные свойства зависят от того, какая из связей в цепочке Э-O-H оказывается менее прочной. Если Э-O, то при диссоциации соединение проявляет основные свойства (Э-O-H→Э++OH-), если O-H – кислотные (Э-O-H→ЭO-+H+). Прочность связей в первую очередь определяется степенью окисления и ионным радиусом элемента. Увеличение степени окисления и уменьшение ионного радиуса вызывают смещение электронной плотности в цепочке Э←O←H, что приводит к ослаблению связи O-H и усилению связи Э-O, то есть усилению кислотных.
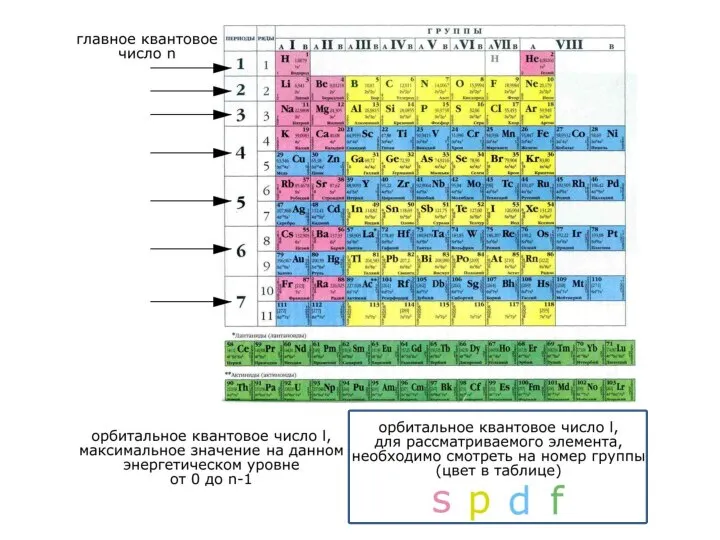
Слайд 25Для характеристики поведения электрона в атоме в соответствии с уравнением Шредингера введены
Для характеристики поведения электрона в атоме в соответствии с уравнением Шредингера введены
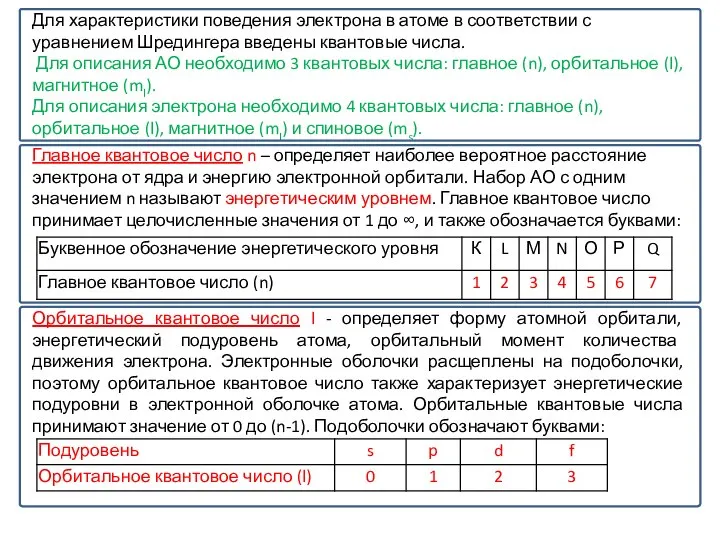
Для описания АО необходимо 3 квантовых числа: главное (n), орбитальное (l), магнитное (ml).
Для описания электрона необходимо 4 квантовых числа: главное (n), орбитальное (l), магнитное (ml) и спиновое (ms).
Главное квантовое число n – определяет наиболее вероятное расстояние электрона от ядра и энергию электронной орбитали. Набор АО с одним значением n называют энергетическим уровнем. Главное квантовое число принимает целочисленные значения от 1 до ∞, и также обозначается буквами:
Орбитальное квантовое число l - определяет форму атомной орбитали, энергетический подуровень атома, орбитальный момент количества движения электрона. Электронные оболочки расщеплены на подоболочки, поэтому орбитальное квантовое число также характеризует энергетические подуровни в электронной оболочке атома. Орбитальные квантовые числа принимают значение от 0 до (n-1). Подоболочки обозначают буквами:
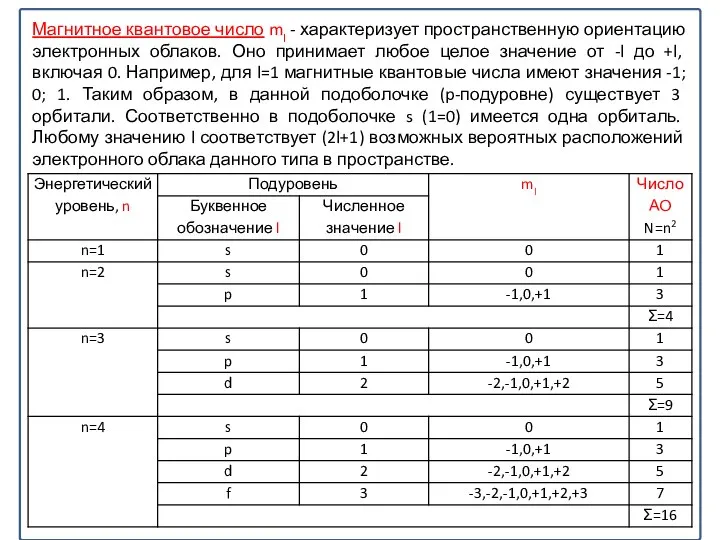
Слайд 26Магнитное квантовое число ml - характеризует пространственную ориентацию электронных облаков. Оно принимает
Магнитное квантовое число ml - характеризует пространственную ориентацию электронных облаков. Оно принимает
Слайд 27Формы электронных облаков вероятности различных атомных орбиталей
Формы электронных облаков вероятности различных атомных орбиталей
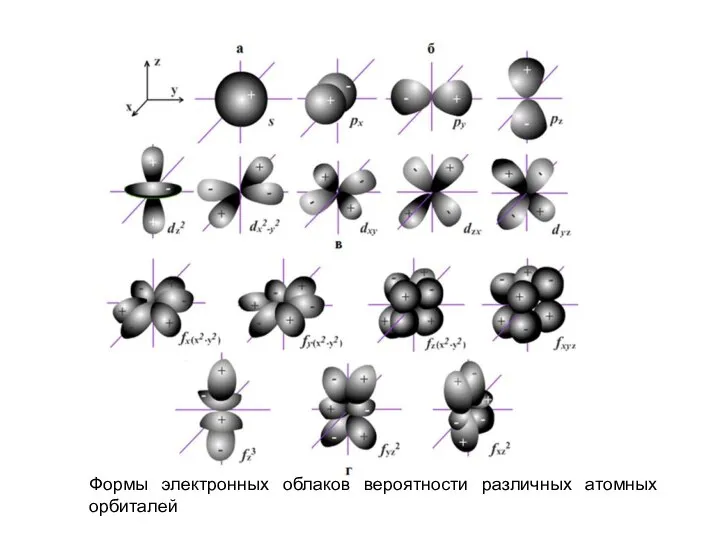
Слайд 28Спиновое квантовое число ms - характеризует вращение электрона вокруг собственной оси (спин),
Спиновое квантовое число ms - характеризует вращение электрона вокруг собственной оси (спин),

Численно принимают значения ms за +1/2 или -1/2.
Например, при составлении схем электроны обозначают:
s электроны ns1
p электроны np4
d электроны (n-1)d5
f электроны (n-2)f3
Слайд 29Электрон, который последним заполняет орбитали атома элемента называют формирующим. В периодической системе
Электрон, который последним заполняет орбитали атома элемента называют формирующим. В периодической системе

Элементы-аналоги – элементы, имеющие одинаковое строение внешних электронных оболочек и расположенные в одной подгруппе.
Например
IV группа:
Главная подгруппа, элементы-аналоги:
C 2s22p2, Si 3s23p2, Ge 4s24p2, Sn 5s25p2, Pb 6s26p2
IV группа:
Побочная подгруппа, элементы-аналоги:
Ti 3d24s2, Zr 4d25s2, Hf 5d26s2
Примеры:
s- элементы
Примеры:
p- элементы
Примеры:
d- элементы
Слайд 31Блоки таблицы включают элементы, у которых формируется один тип орбиталей (подуровень):
s- блок
Блоки таблицы включают элементы, у которых формируется один тип орбиталей (подуровень):
s- блок
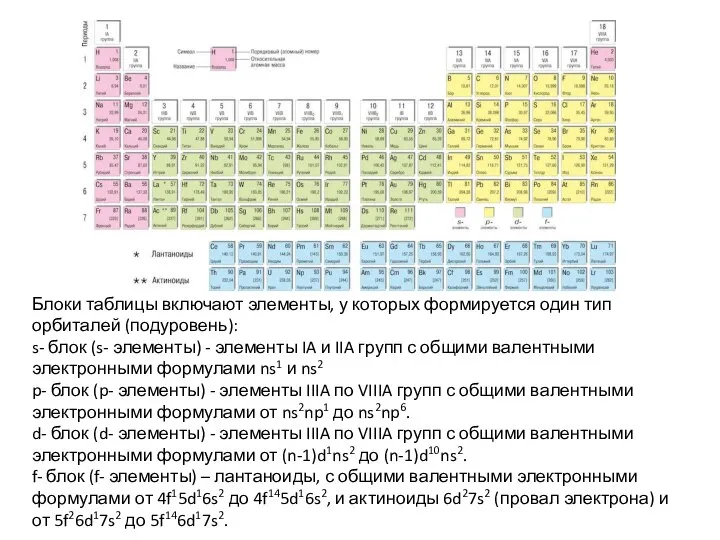
p- блок (p- элементы) - элементы IIIA по VIIIA групп с общими валентными электронными формулами от ns2np1 до ns2np6.
d- блок (d- элементы) - элементы IIIA по VIIIA групп с общими валентными электронными формулами от (n-1)d1ns2 до (n-1)d10ns2.
f- блок (f- элементы) – лантаноиды, с общими валентными электронными формулами от 4f15d16s2 до 4f145d16s2, и актиноиды 6d27s2 (провал электрона) и от 5f26d17s2 до 5f146d17s2.
Слайд 32Принцип Паули. В атоме не может быть двух электронов с одинаковыми значениями
Принцип Паули. В атоме не может быть двух электронов с одинаковыми значениями

на одной орбитали не может быть двух электронов с одинаковыми спинами
ПРАВИЛЬНО НЕПРАВИЛЬНО
- максимальное число электронов на энергетическом подуровне: 2(2l+1)
- максимально возможное число электронов на каждом энергетическом уровне равно удвоенному значению квадрата главного квантового числа: N = 2n2.
Правило Гунда. Правило Гунда применяется при заполнении электрoнами энергетических подуровней. В данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы их суммарный спин был максимальным, суммарный спин спаренных электронов равен нулю. Так, если в трех р — ячейках надо разместить три электрона, то каждый из них будет располагаться в отдельной ячейке с параллельным спином.
ПРАВИЛЬНО НЕПРАВИЛЬНО
Σspin=+ ½ + ½ + ½ + ½ + ½ =2 ½ Σspin=+ ½ - ½ + ½ - ½ + ½ = ½
Слайд 33Принцип наименьшей энергии. Электроны в атоме занимают наиболее низкое энергетическое состояние, отвечающее
Принцип наименьшей энергии. Электроны в атоме занимают наиболее низкое энергетическое состояние, отвечающее
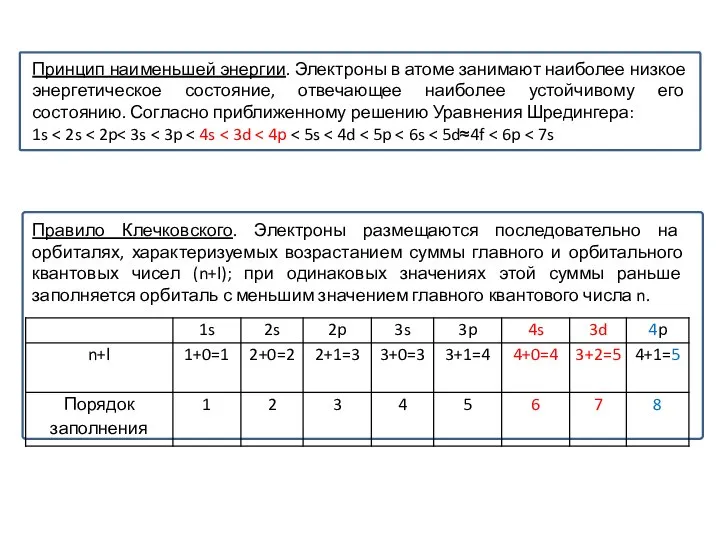
1s < 2s < 2p< 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d≈4f < 6p < 7s
Правило Клечковского. Электроны размещаются последовательно на орбиталях, характеризуемых возрастанием суммы главного и орбитального квантовых чисел (n+l); при одинаковых значениях этой суммы раньше заполняется орбиталь с меньшим значением главного квантового числа n.
Слайд 34Алгоритм составления электронной конфигурации атома:
1. По координатам или порядковому номеру устанавливают положение
Алгоритм составления электронной конфигурации атома:
1. По координатам или порядковому номеру устанавливают положение

№ 3 или 2 II А – литий Li; № 13 или 3 III A – алюминий Al; № 23 или 4 V Б – ванадий V;
№ 33 или 4 V А – мышьяк As; № 93 или 7 III Б – нептуний Np.
2. Определяют, к какому семейству (s-, p-, d или f-) элементов относится рассматриваемый атом, и записывают валентные электроны: Литий – s- элемент, 2s1; Алюминий – p- элемент, 3s23p1; Ванадий – d- элемент, 3d34s2; Мышьяк – p- элемент, 4s24p3; Нептуний – f- элемент, 5f46d17s2.
3. Для составления полной электронной конфигурации, описывают все заполненные внутренние электронные уровни, начиная с первого и отмечают валентные электроны, которые отмечают подчеркиванием:
Li…1s22s1;
Al…1s22s22p63s23p1;
V…1s22s22p63s23p63d34s2 или V…1s22s22p63s23p64s23d3
As…1s22s22p63s23p63d104s24p3, для p- элементов, имеющих полностью заполненный предвнешний d- подуровень, последний необходимо писать до внешнего s- подуровня. В этом случае d- подуровень не является валентным.
Np... 1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p6 5f46d17s2
Слайд 35При составлении краткой электронной конфигурации невалентные электроны заменяют символом благородного газа (полный
При составлении краткой электронной конфигурации невалентные электроны заменяют символом благородного газа (полный

Li…[He] 2s1;
Al…[Ar] 3s23p1;
V…[Ar] 3d34s2;
As…[Ar, 3d10] 4s24p3, для p- элементов, имеющих полностью заполненный предвнешний d- подуровень, последний необходимо указывать в квадратных скобках после символа благородного газа, которым завершился предыдущий период. Если указать d- подуровень после скобок, это будет означать, что d- электроны – валентны, что неправильно определяет p- элемент. Если d подуровень не указать вообще, это тоже неправильно, поскольку он не входит в электронную оболочку благородного газа, завершающего предыдущий период.
Np… [Rn] 5f46d17s2.
Слайд 36Экспериментально установлено, что для ряда d и f –элементов, в частности с
Экспериментально установлено, что для ряда d и f –элементов, в частности с

Схематическая запись рассмотренных элементов выглядит следующим образом:
Слайд 37Алгоритм описания квантовых чисел
Li…[He] 2s1. 2-й период – главное квантовое число n=2.
Алгоритм описания квантовых чисел
Li…[He] 2s1. 2-й период – главное квантовое число n=2.
![Алгоритм описания квантовых чисел Li…[He] 2s1. 2-й период – главное квантовое число](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/981820/slide-36.jpg)
Атомная орбиталь: n=2, l=0, ml=0.
Формирующий электрон: n=2, l=0, ml=0; ms=±1/2 (одно из значений).
Al…[Ar] 3s23p1. 3-й период – главное квантовое число n=3. Алюминий – p- элемент, то есть l=1. Если l=1, значит ml=-1;0;+1.
Атомная орбиталь: n=3, l=1, ml=-1;0;+1.
Формирующий электрон: n=3, l=1, ml=-1;0;+1 (одно из значений); ms=±1/2 (одно из значений).
V…[Ar] 3d34s2. !Формирующий электрон d- элементов находится на предвнешнем электронном уровне! Несмотря на то, что ванадий находится в четвертом периоде, формирующий электрон находится на 3d подуровне!
3-й период – главное квантовое число n=3. Ванадий – d- элемент, то есть l=2. Если l=2, значит ml=-2;-1;0;+1;+2.
Атомная орбиталь: n=3, l=2, ml=-2;-1;0;+1;+2.
Формирующий электрон: n=3, l=2, ml=-2;-1;0;+1;+2 (одно из значений); ms=±1/2 (одно из значений).
Слайд 38As…[Ar, 3d10] 4s24p3. 4-й период – главное квантовое число n=4. Мышьяк –
As…[Ar, 3d10] 4s24p3. 4-й период – главное квантовое число n=4. Мышьяк –
![As…[Ar, 3d10] 4s24p3. 4-й период – главное квантовое число n=4. Мышьяк –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/981820/slide-37.jpg)
Атомная орбиталь: n=4, l=1, ml=-1;0;+1.
Формирующий электрон: n=4, l=1, ml=-1;0;+1 (одно из значений); ms=±1/2 (одно из значений).
Np… [Rn] 5f46d17s2. !Формирующий электрон f- элементов находится на предпредвнешнем электронном уровне! Несмотря на то, что нептуний находится в седьмом периоде, формирующий электрон находится на 5f подуровне!
5-й период – главное квантовое число n=5. Нептуний – f- элемент, то есть l=3. Если l=3, значит ml=-3;-2-1;0;+1;+2;+3.
Атомная орбиталь: n=5, l=3, ml=-3;-2-1;0;+1;+2;+3.
Формирующий электрон: n=5, l=3, ml=-3;-2-1;0;+1;+2;+3 (одно из значений); ms=±1/2 (одно из значений).
Слайд 39При сообщении атому энергии (в результате столкновения с другим атомом, поглощения кванта
При сообщении атому энергии (в результате столкновения с другим атомом, поглощения кванта

Пример:
B 1s22s22p1 или [He] 2s22p1 - основное состояние
B* 1s22s12p2 или [He] 2s12p2- возбужденное состояние.
Валентность - способность атома присоединять или замещать определенное число других атомов с образованием химических связей. Валентность по обменному механизму равна числу внешних неспаренных электронов в атоме. Различают: - валентность в основном (В), - в возбужденном (В*) состоянии атома.
Mg 3s2 Mg* 3s13p1
O 2s22p4 F 2s22p5 возбужденного состояния нет
Cl 3s23p5 – аналог фтора – валентности: В=1, В*= 3, 5, 7 - вследствие наличия свободных d-орбиталей на третьем энергетическом уровне.
Кобальт Cо … 3d74s2 В = 0 – нет внешних неспаренных электронов в основном состоянии. Для большинства d-элементов валентность в основном состоянии В= 0, т.к. на внешнем уровне нет неспаренных электронов. При переходе в возбужденное состояние s-электроны распариваются, валентность возрастает. При этом, кроме внешних валентными становятся неспаренные d-электроны предвнешнего подуровня.
Слайд 41Валентная конфигурация или сокращенная электронная формула
-содержит только валентные электроны (наиболее активные,
Валентная конфигурация или сокращенная электронная формула
-содержит только валентные электроны (наиболее активные,

Примеры:
Литий Li … 2s1. квантовые числа для формирующего электрона 2s:
n = 2, l = 0, ml = 0, ms =+1/2 или –1/2; валентность: В =1.
Азот N … 2s22p3 квантовые числа для формирующего электрона 2р:
n = 2, l = 1, ml = -1,0,+1(одно из), ms =+1/2 или –1/2;
валентность: В = 3
Хлор Cl … 3s23p5 квантовые числа для формирующего электрона 3р:
n = 3, l = 1, ml = -1, 0, +1 (одно из), ms =+1/2 или –1/2;
валентность: В = 1, В* = 3,5,7.
Слайд 42Марганец Мn … 3d54s2
квантовые числа для формирующего электрона 3d:
n = 3,
Марганец Мn … 3d54s2
квантовые числа для формирующего электрона 3d:
n = 3,

ms = +1/2 или –1/2;
валентность: В = 0, В* = 2,3,4,5,6,7.
Серебро Ag … 4d105s1
квантовые числа для формирующего электрона 4d:
n = 4, l = 2, ml = -2, -1, 0 ,+1 ,+2 (одно из),
ms =+1/2 или –1/2;
валентность: В = 1.
Уран U … 5f36d17s2
квантовые числа для формирующего электрона 5f :
n = 5, l = 3, ml = -3, -2, -1, 0 ,+1 ,+2, +3 (одно из),
ms = +1/2 или –1/2;
валентность: В = 0, В* = 1,2,3.
Полная электронная конфигурация урана:
U92 : 1s22s22p63s23p63d104s24p64d104f145s25p65d105f36s26p66d17s2


 Классификация коррозионных процессов металлов
Классификация коррозионных процессов металлов Пропи́н (метилацетилен, аллилен)
Пропи́н (метилацетилен, аллилен) Щелочные металлы
Щелочные металлы Алканы: строение, номенклатура, изомерия, физические свойства
Алканы: строение, номенклатура, изомерия, физические свойства Презентация на тему Генетическая связь между классами неорганических вещ-в
Презентация на тему Генетическая связь между классами неорганических вещ-в  Минералы
Минералы Презентация на тему Реакции соединения (8 класс)
Презентация на тему Реакции соединения (8 класс)  Янтарь
Янтарь Строение вещества
Строение вещества Этиленовые углеводороды
Этиленовые углеводороды Воздух. Относительная плотность газов
Воздух. Относительная плотность газов Основные обозначения. Основные понятия. Практическая работа № 2
Основные обозначения. Основные понятия. Практическая работа № 2 Алкены
Алкены Практическая работа: Очистка загрязнённой поваренной соли
Практическая работа: Очистка загрязнённой поваренной соли Скорость химических реакций
Скорость химических реакций Супер-химия. Викторина
Супер-химия. Викторина Химические явления
Химические явления Понятие о скорости химической реакции
Понятие о скорости химической реакции Термодинамика. Основные понятия и законы. Особенности термодинамики живых систем
Термодинамика. Основные понятия и законы. Особенности термодинамики живых систем Неметаллы IV-VI групп
Неметаллы IV-VI групп Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты)
Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты) Химическое равновесие. Экзаменационные вопросы
Химическое равновесие. Экзаменационные вопросы Первый закон термодинамики. Термохимия
Первый закон термодинамики. Термохимия Презентация на тему Увлекательные факты из жизни Менделеева
Презентация на тему Увлекательные факты из жизни Менделеева  Задачи на ионные равновесия
Задачи на ионные равновесия Основные классы неорганических соединений
Основные классы неорганических соединений Кремень – камень
Кремень – камень Липиды. Состав липидов
Липиды. Состав липидов