Содержание
- 2. B
- 3. (атом кислорода)
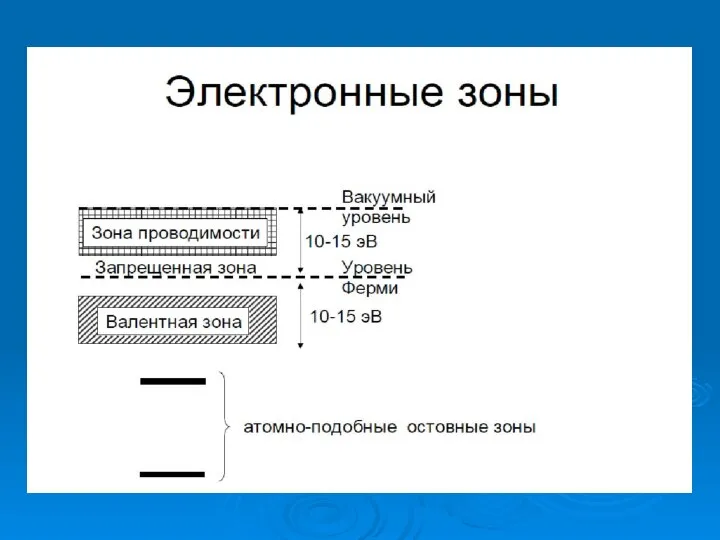
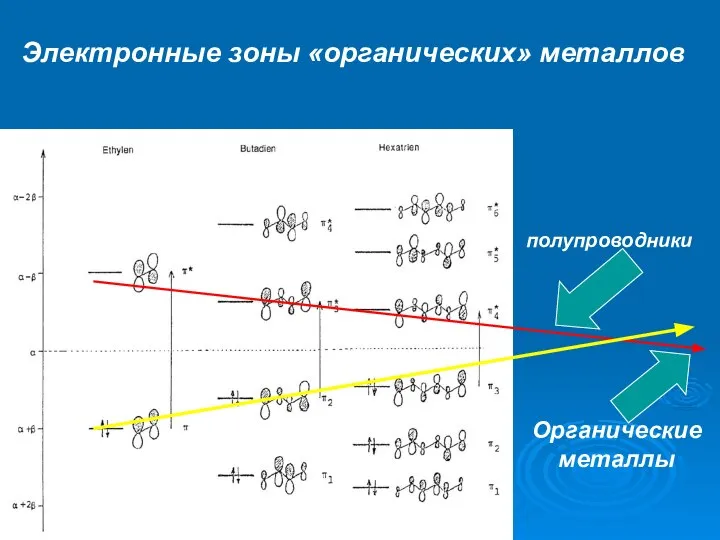
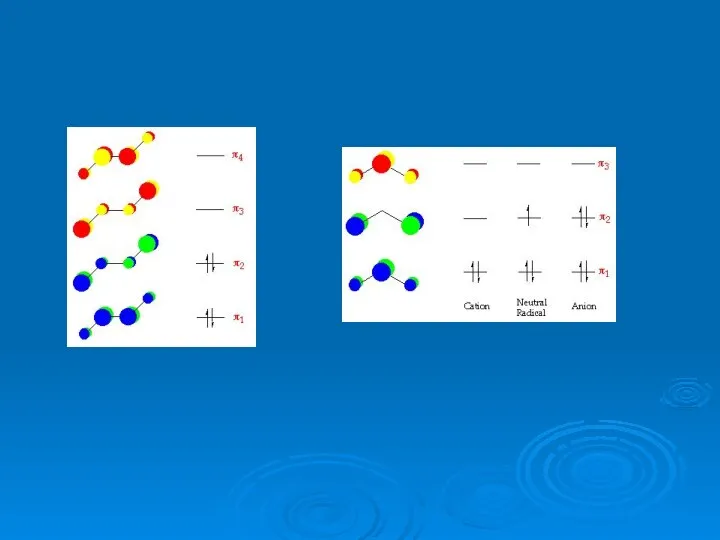
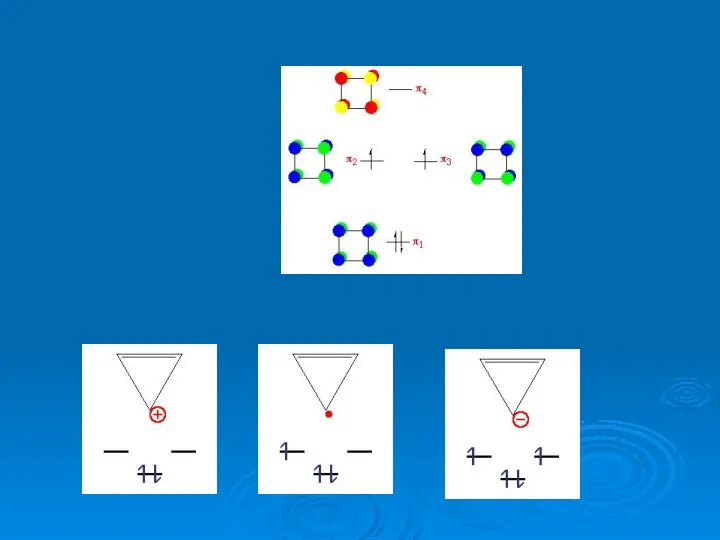
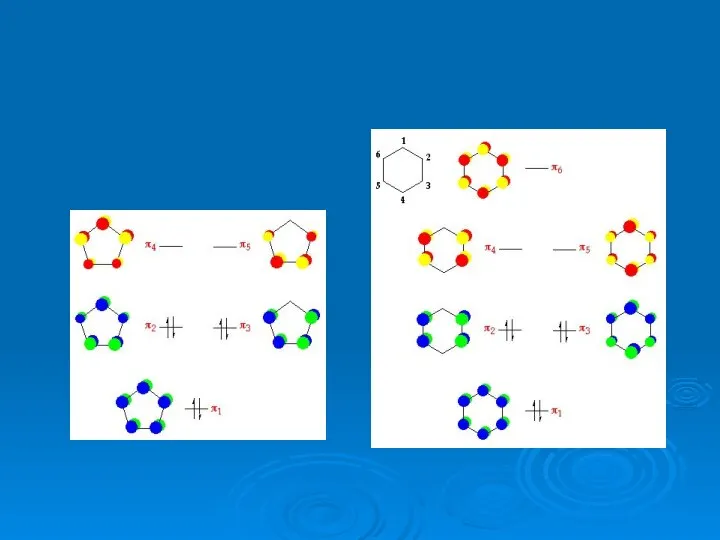
- 7. Органические металлы полупроводники Электронные зоны «органических» металлов
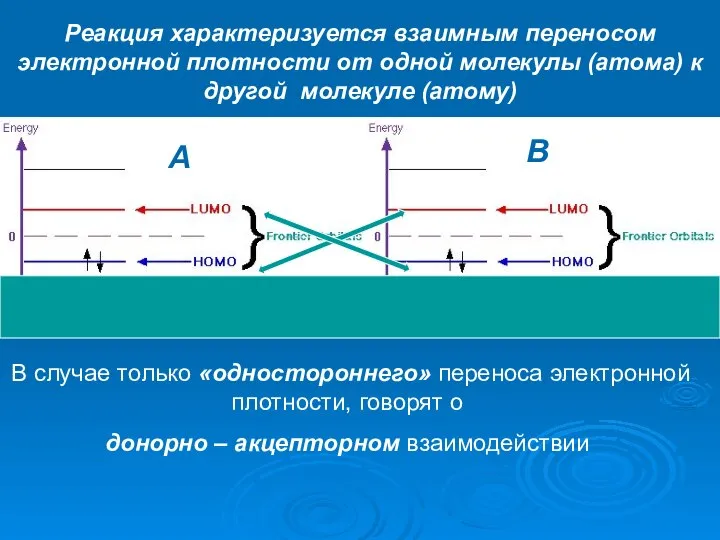
- 8. A B Реакция характеризуется взаимным переносом электронной плотности от одной молекулы (атома) к другой молекуле (атому)
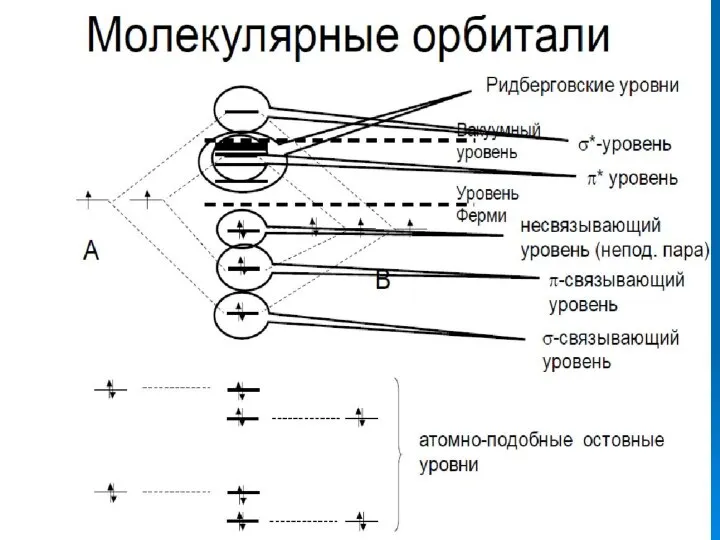
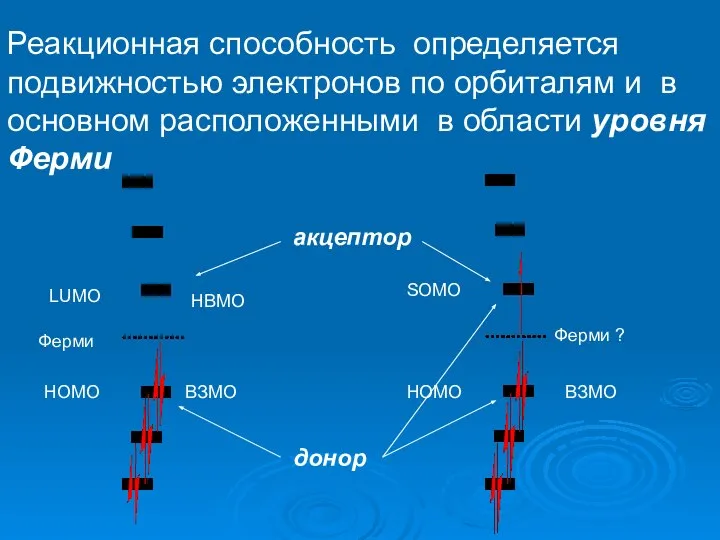
- 9. B Реакционная способность определяется подвижностью электронов по орбиталям и в основном расположенными в области уровня Ферми
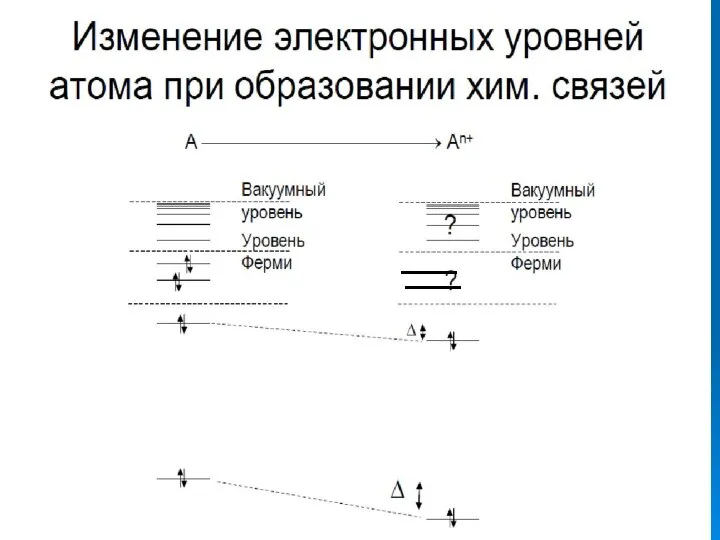
- 10. Свойства валентных электронных уровней (10 – 15 эВ ниже уровня Ферми) и вакантных электронных уровней (10
- 11. Очевидно, что реакционная способность молекул зависит от расположения (т.е. энергии) МО надо только освободить молекулу, «отпустить»
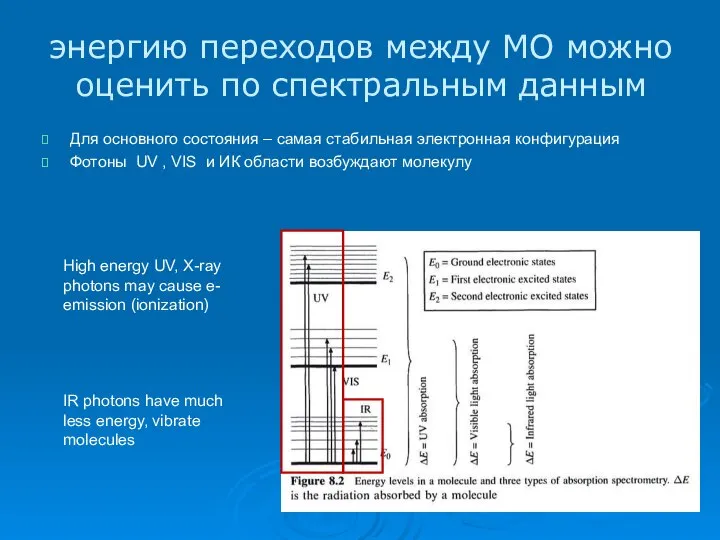
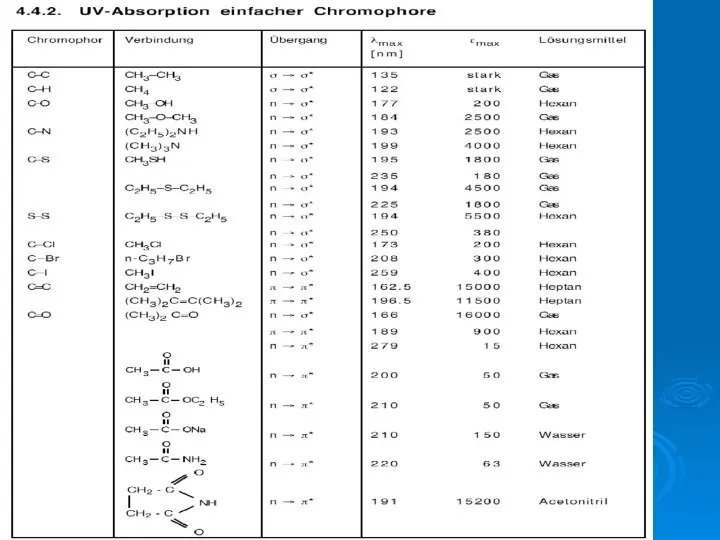
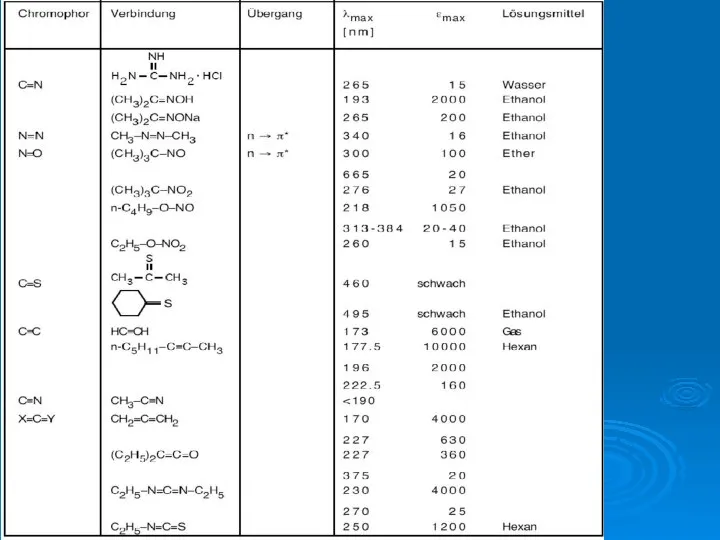
- 12. энергию переходов между МО можно оценить по спектральным данным Для основного состояния – самая стабильная электронная
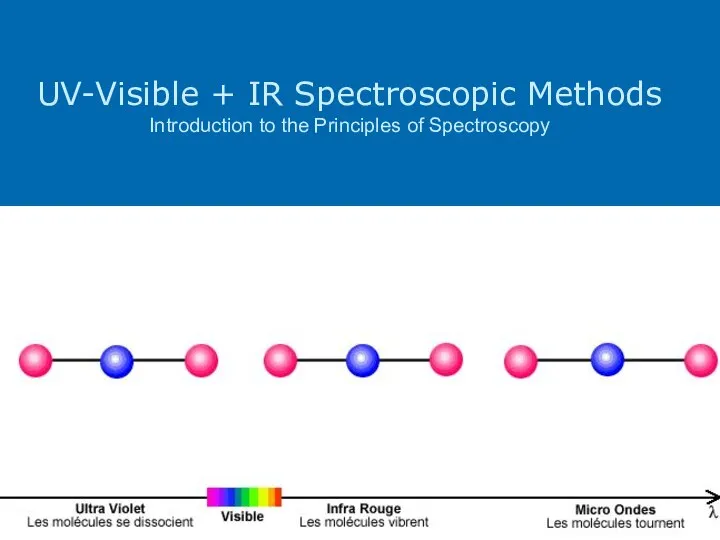
- 13. UV-Visible + IR Spectroscopic Methods Introduction to the Principles of Spectroscopy
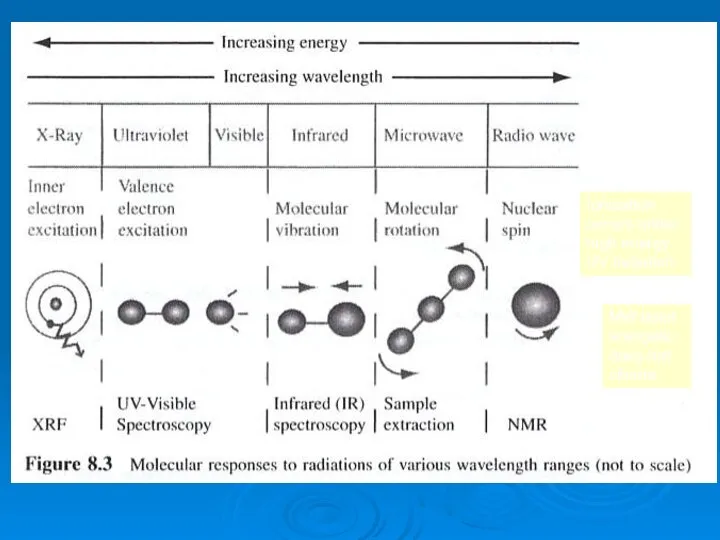
- 14. UV-Visible + IR Spectroscopic Methods Introduction to the Principles of Spectroscopy Ionization occurs under high energy
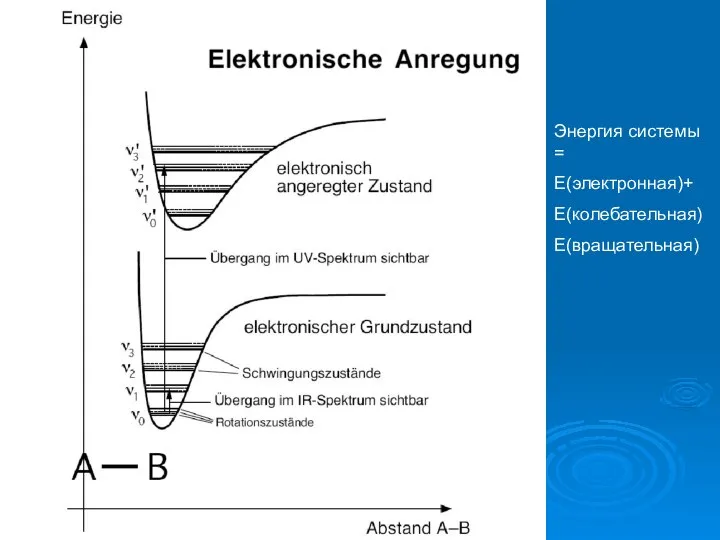
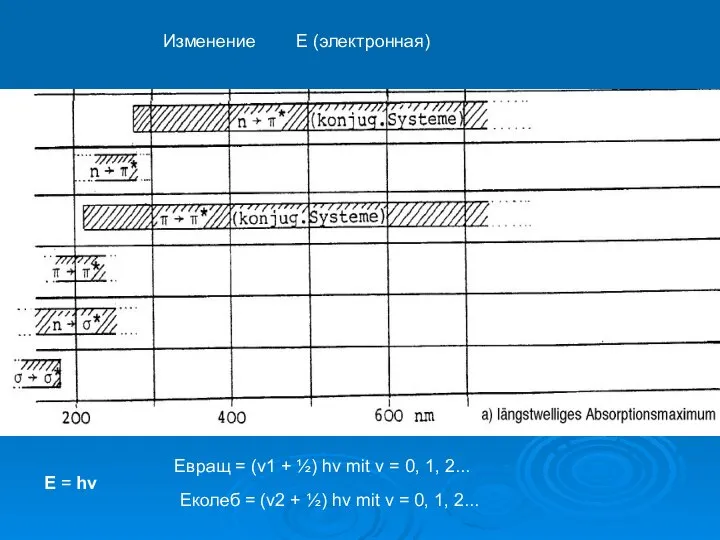
- 15. Энергия системы = Е(электронная)+ Е(колебательная) Е(вращательная)
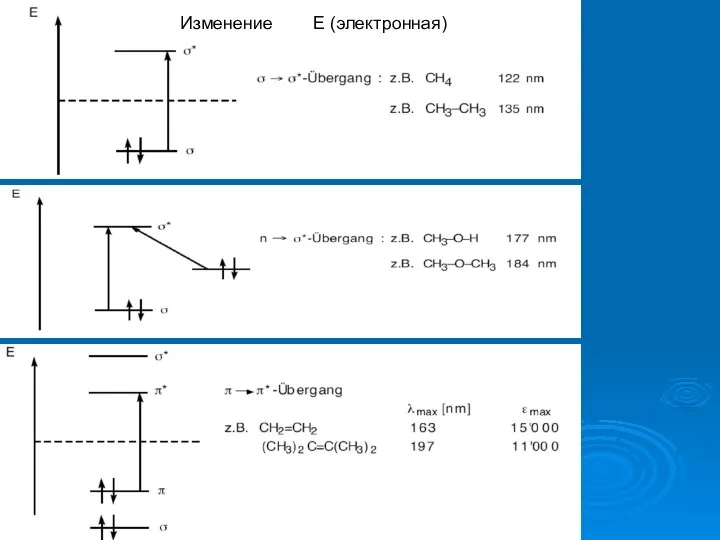
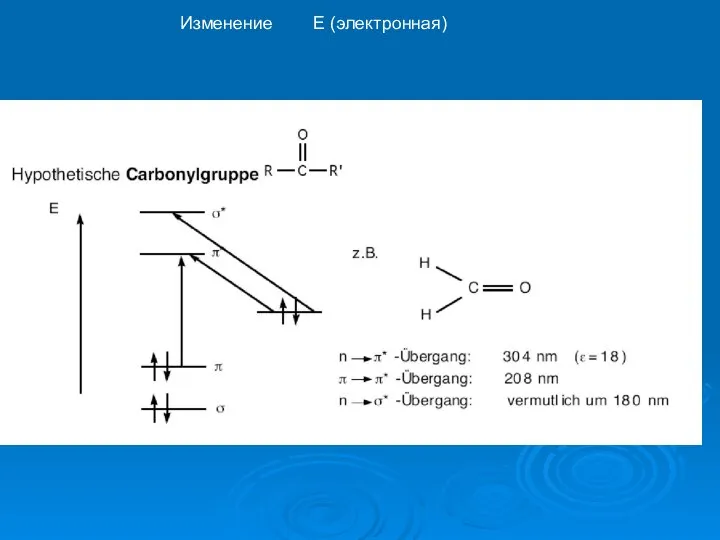
- 16. Изменение Е (электронная)
- 17. Изменение Е (электронная)
- 20. Изменение Е (электронная) E = hν Eвращ = (v1 + ½) hν mit v = 0,
- 21. 3. Inversion in an SN2 Reaction
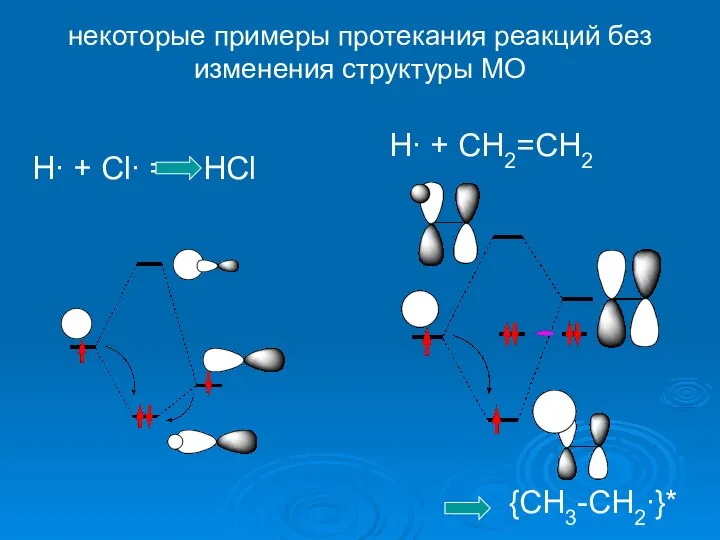
- 22. некоторые примеры протекания реакций без изменения структуры МО H∙ + Cl∙ = HCl H∙ + CH2=CH2
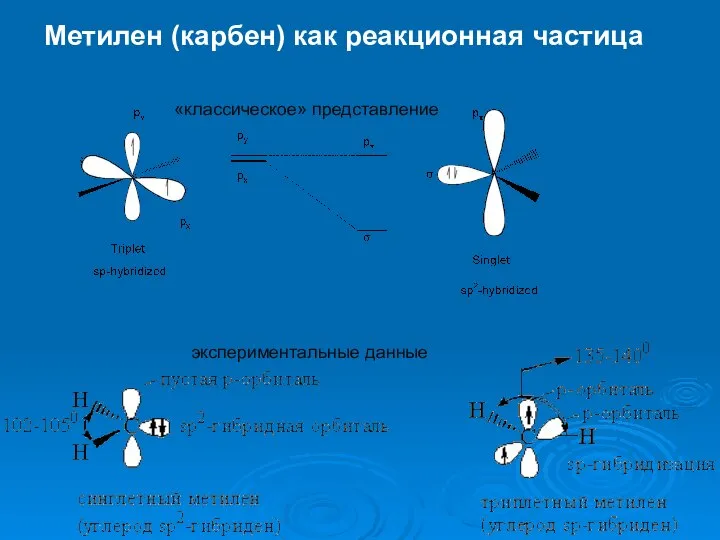
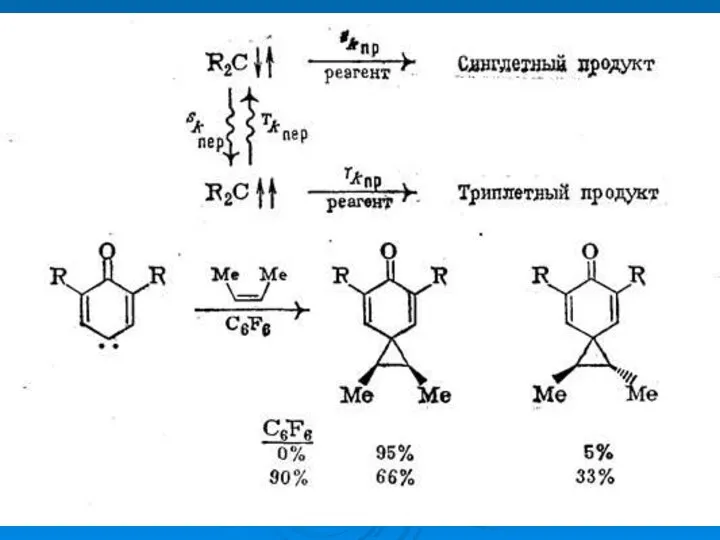
- 23. Метилен (карбен) как реакционная частица «классическое» представление экспериментальные данные
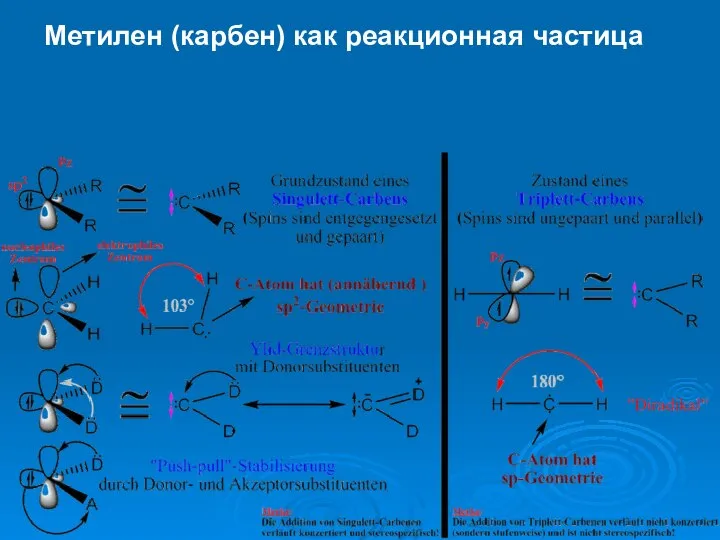
- 24. Метилен (карбен) как реакционная частица
- 25. Присоединение синглетной формы карбена по двойной связи происходит, строго стереоспецифично.
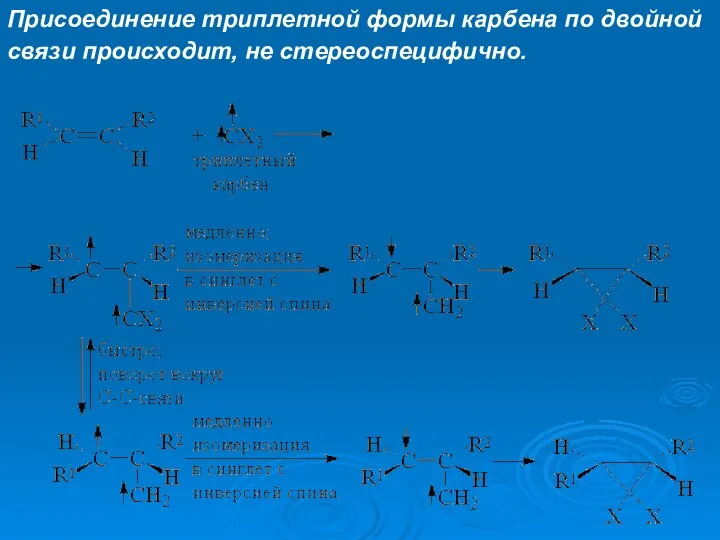
- 26. Присоединение триплетной формы карбена по двойной связи происходит, не стереоспецифично.
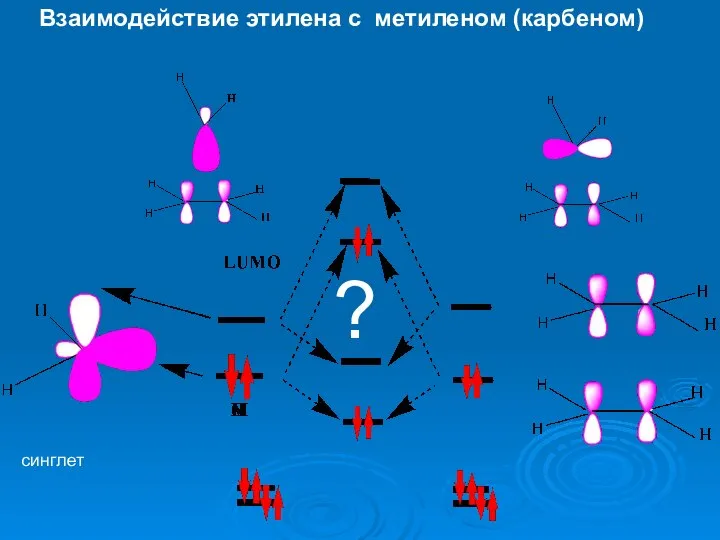
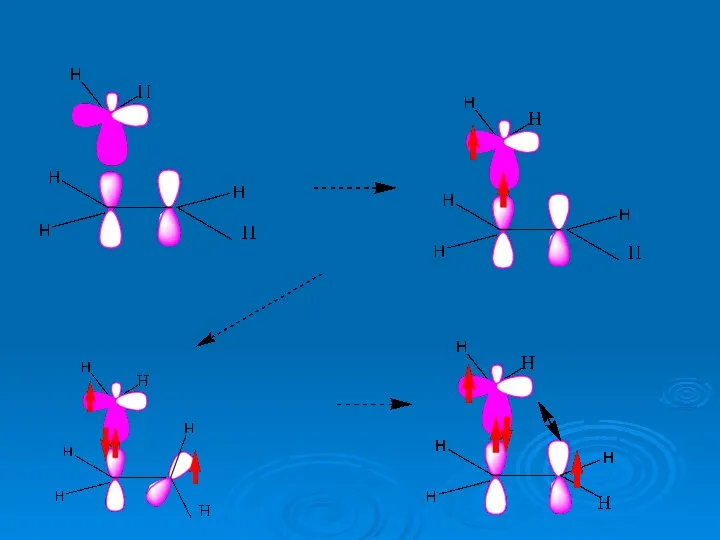
- 28. Взаимодействие этилена с метиленом (карбеном) синглет ?
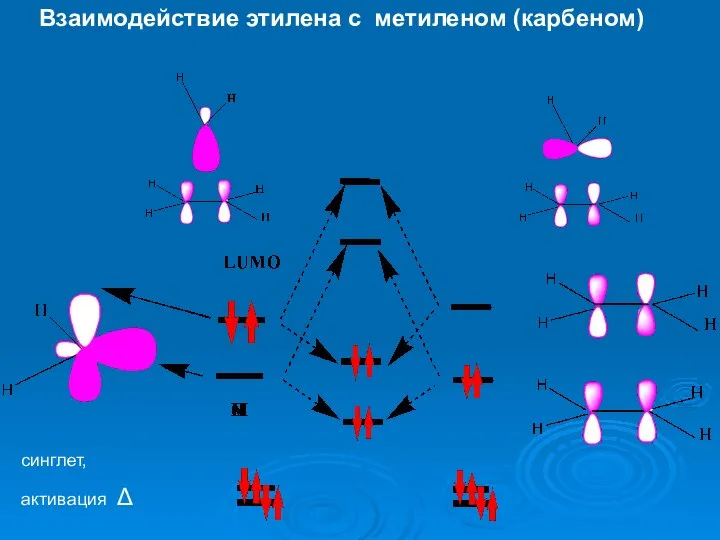
- 29. Взаимодействие этилена с метиленом (карбеном) синглет, активация Δ
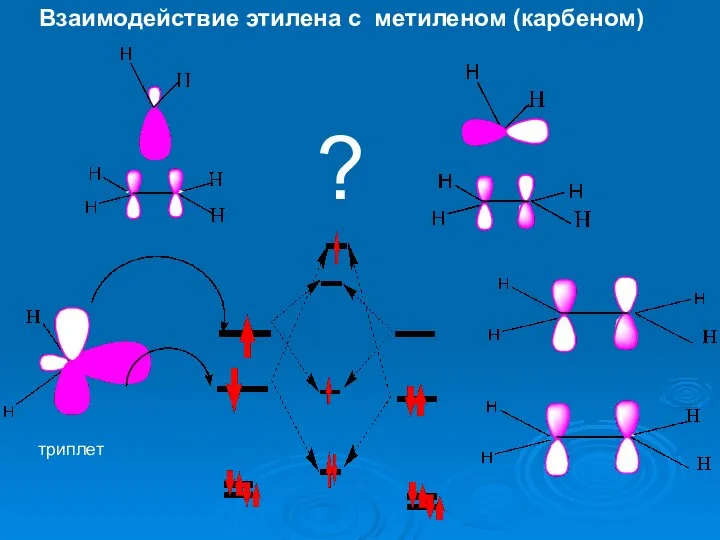
- 30. Взаимодействие этилена с метиленом (карбеном) триплет ?
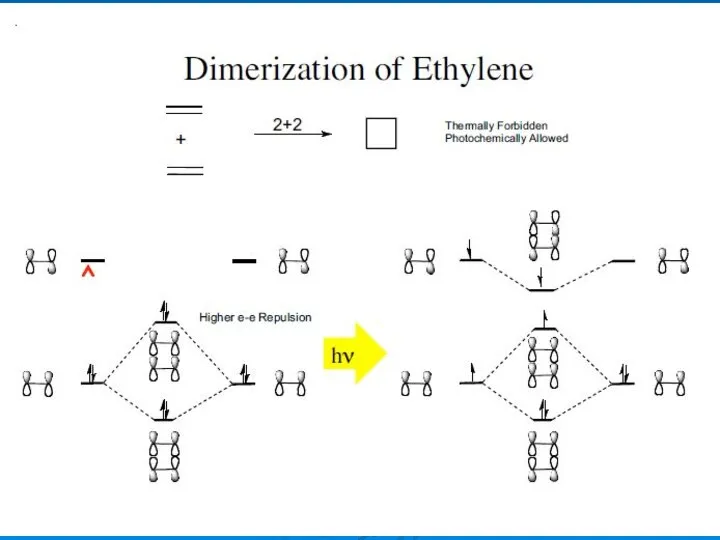
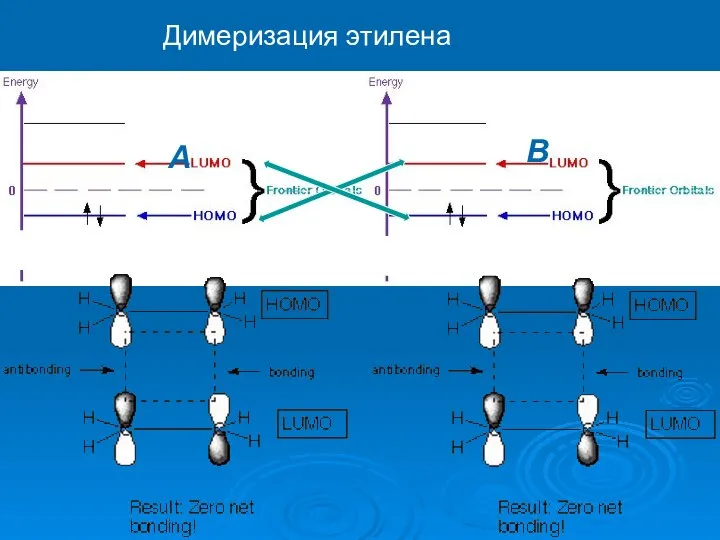
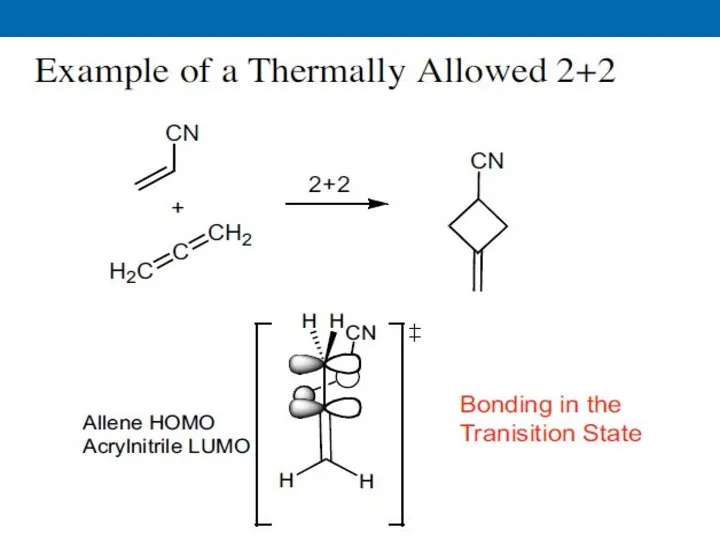
- 33. A B Димеризация этилена
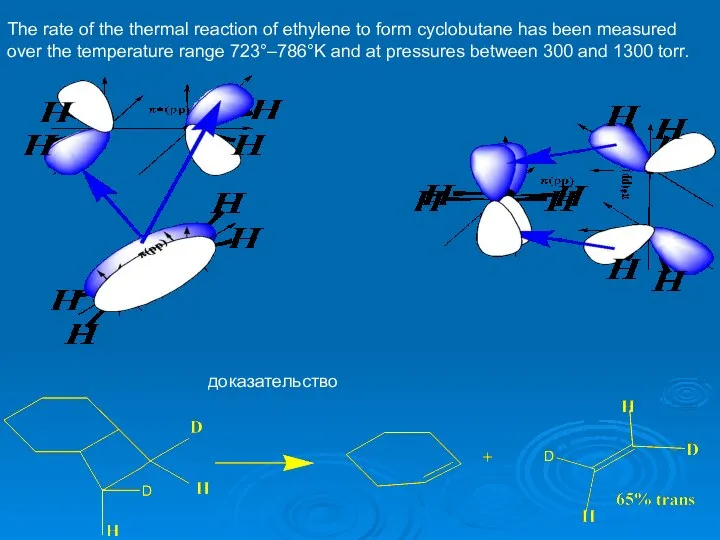
- 34. The rate of the thermal reaction of ethylene to form cyclobutane has been measured over the
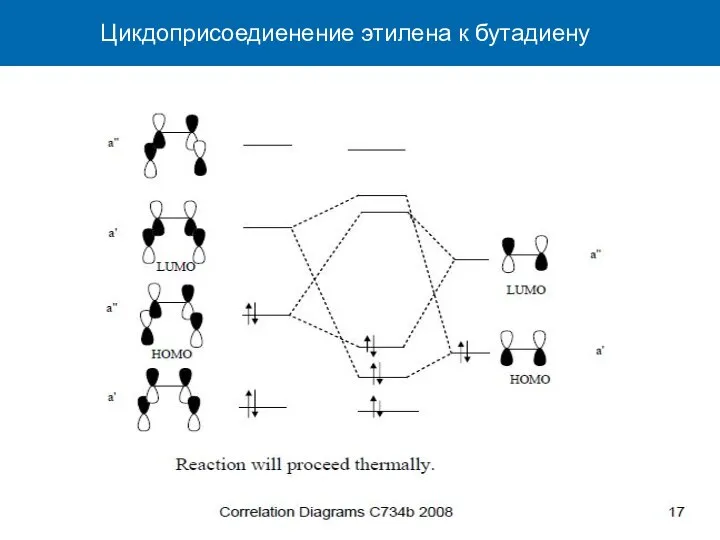
- 36. Цикдоприсоедиенение этилена к бутадиену
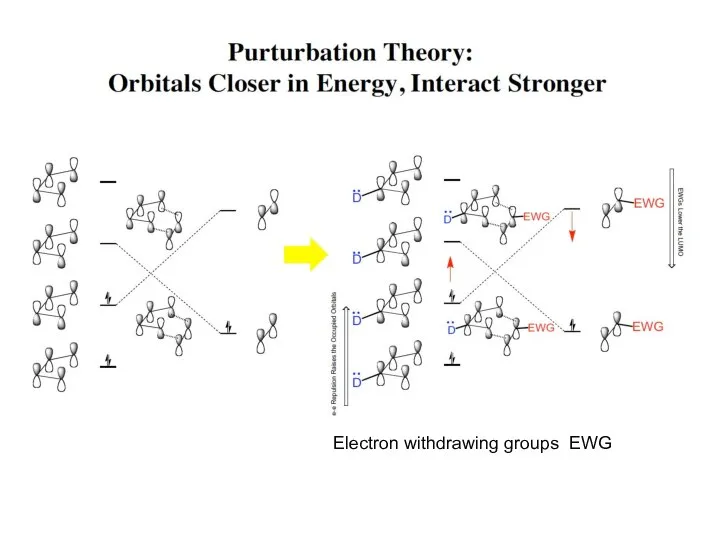
- 38. Electron withdrawing groups EWG
- 39. реакционная способность молекул зависит не только от расположения МО, но и от их строения Однако, необходимо
- 40. некоторые примеры протекания реакций с изменением структуры МО
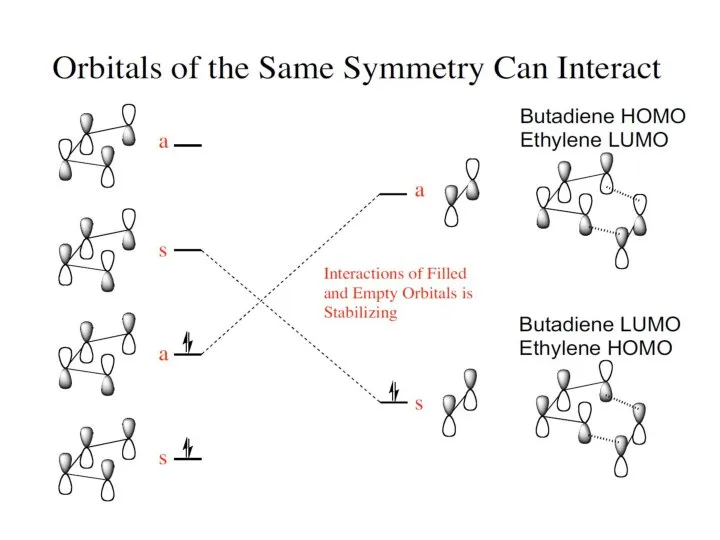
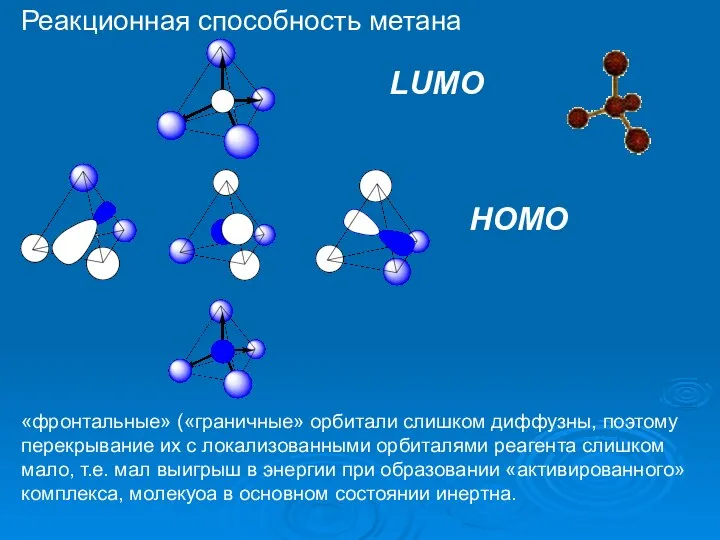
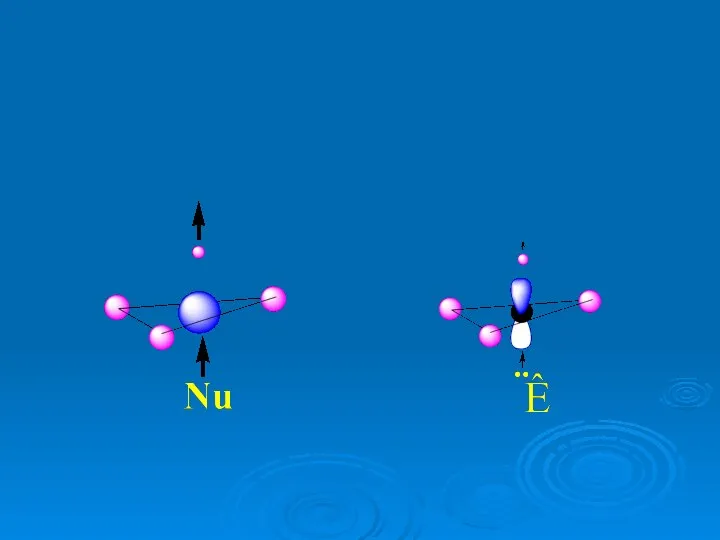
- 41. LUMO HOMO «фронтальные» («граничные» орбитали слишком диффузны, поэтому перекрывание их с локализованными орбиталями реагента слишком мало,
- 42. Реакционная способность метана Вращение молекулы не может вызвать изменение геометрии орбиталей (в данном случае – изменение
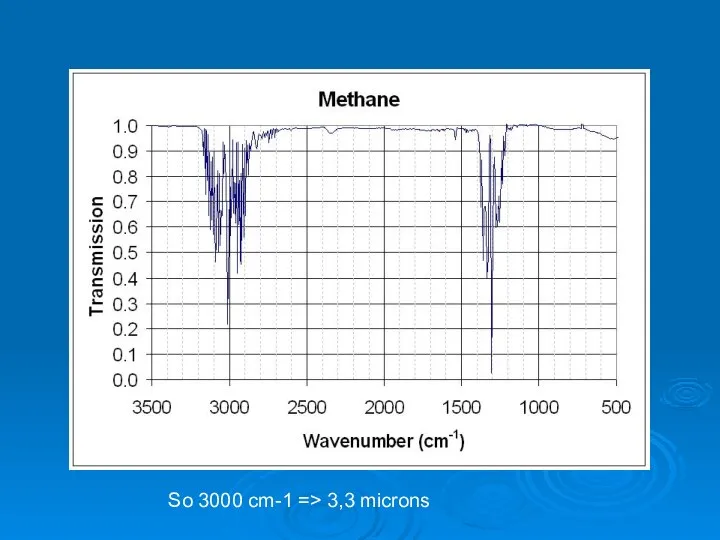
- 43. So 3000 cm-1 => 3,3 microns
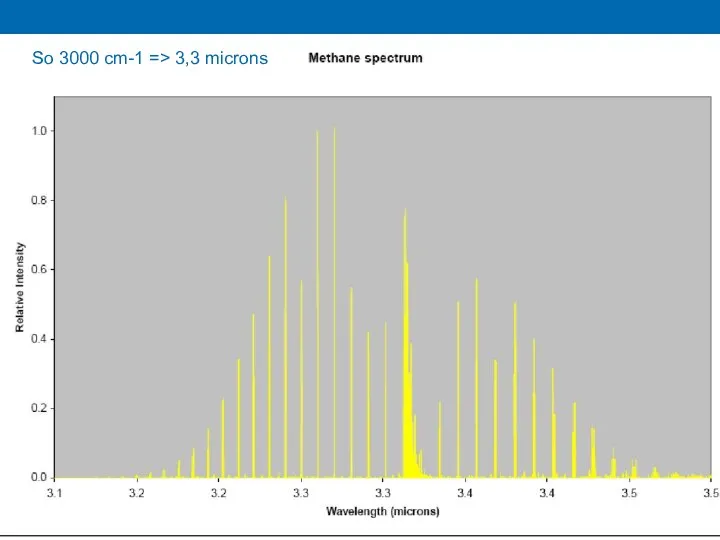
- 45. So 3000 cm-1 => 3,3 microns
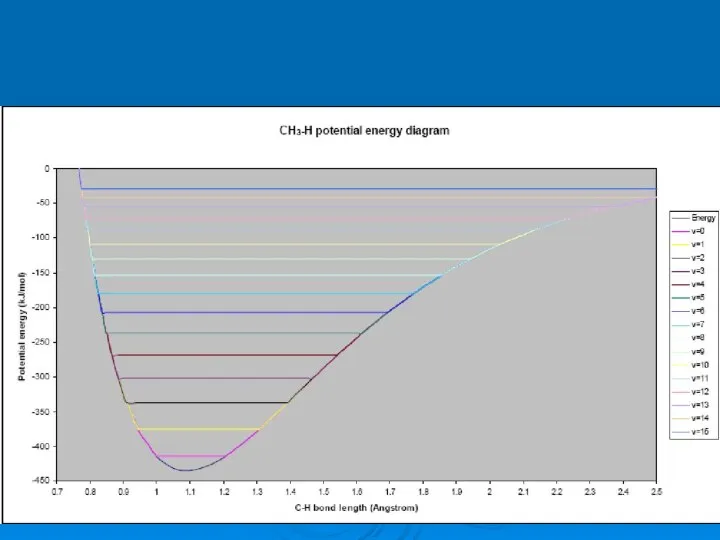
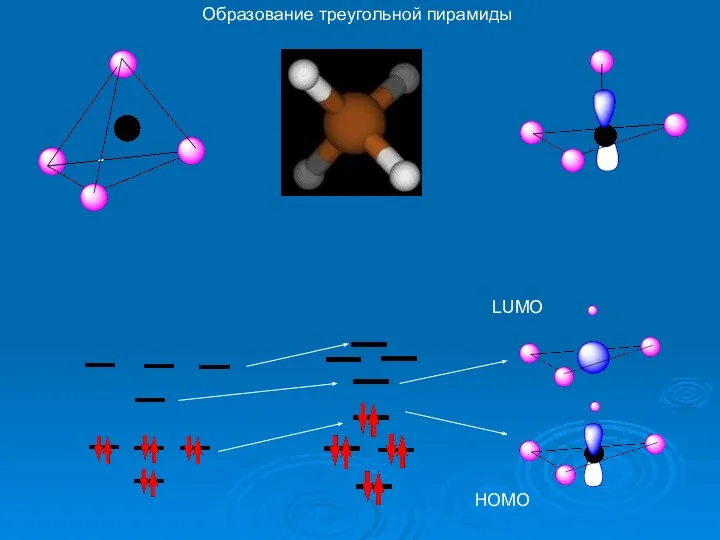
- 46. Основные колебания в метане Образование треугольной пирамиды
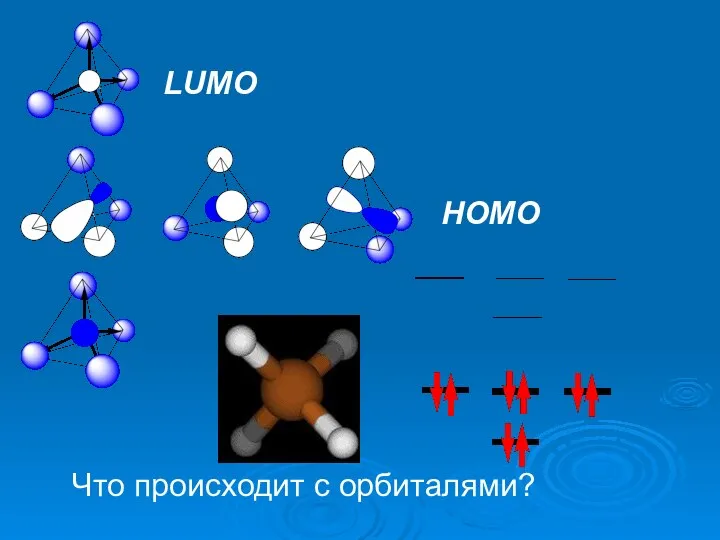
- 47. LUMO HOMO Что происходит с орбиталями?
- 48. Образование треугольной пирамиды LUMO HOMO
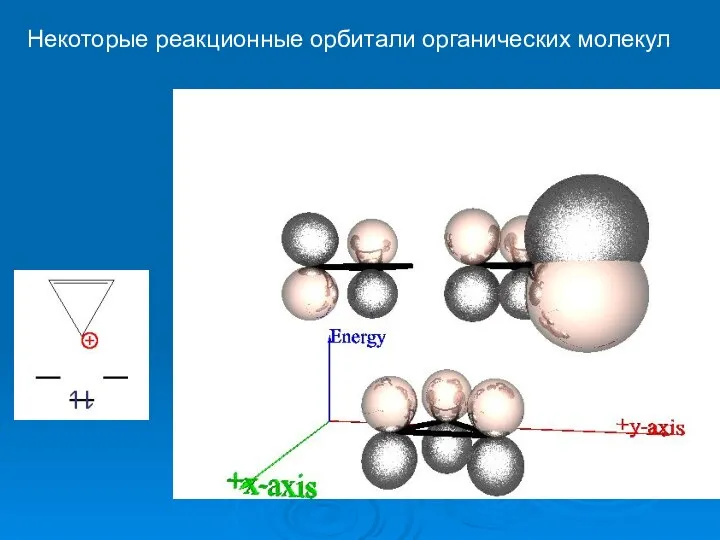
- 50. Некоторые реакционные орбитали органических молекул
- 55. Скачать презентацию









 Щелочные металлы
Щелочные металлы Презентация на тему Изучение реакции среды в зависимости от типа гидролиза соли
Презентация на тему Изучение реакции среды в зависимости от типа гидролиза соли  Приложения для отслеживания проб ALS Geochemistry
Приложения для отслеживания проб ALS Geochemistry Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1
Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1 Химические свойства бензола. Получение, применение. Учитель биологии-химии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировна
Химические свойства бензола. Получение, применение. Учитель биологии-химии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировна Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Презентация на тему Соли угольной кислоты
Презентация на тему Соли угольной кислоты  ліпіди
ліпіди Занимательная химия в 8 классе
Занимательная химия в 8 классе Кристаллическая структура вещества. Вывод формульных единиц по отношению масс элементов и по массовым долям элементов. (Урок №6)
Кристаллическая структура вещества. Вывод формульных единиц по отношению масс элементов и по массовым долям элементов. (Урок №6) Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации Презентация на тему Кристаллы
Презентация на тему Кристаллы  Физические и фазовые состояния полимеров
Физические и фазовые состояния полимеров Мицелла. Строение мицеллы
Мицелла. Строение мицеллы Многоядерные Арены
Многоядерные Арены Биогеотехнология
Биогеотехнология Основания. 8 класс
Основания. 8 класс Из опыта использования интерактивной доски на уроках химии
Из опыта использования интерактивной доски на уроках химии Презентация на тему Полимеры и их получение
Презентация на тему Полимеры и их получение  Соли. Состав и классификация
Соли. Состав и классификация Степень окисления
Степень окисления Строение атома
Строение атома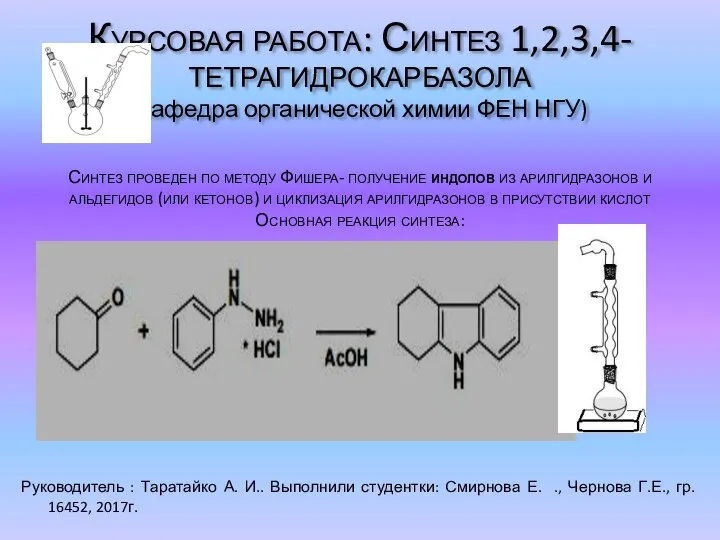 Синтез 1,2,3,4-тетрагидрокарбазола
Синтез 1,2,3,4-тетрагидрокарбазола Производство серной кислоты
Производство серной кислоты Способы получения металлов
Способы получения металлов Мышьяк (As)
Мышьяк (As)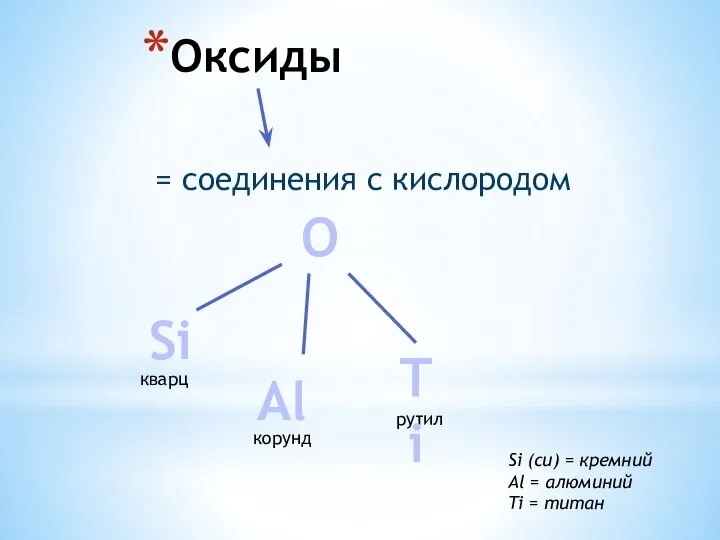 Оксиды. Кварц (SiO2). Корунд (Al2O3)
Оксиды. Кварц (SiO2). Корунд (Al2O3) Биосинтез гема
Биосинтез гема