Слайд 7
Тема урока:
«Классификация кислот. Химические свойства кислот в свете теории электролитической

диссоциации»
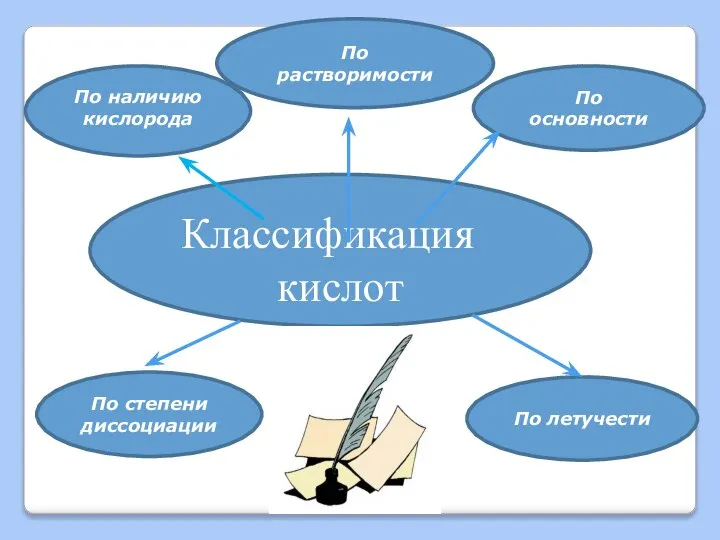
Слайд 9Классификация
кислот
По основности
По степени диссоциации
По наличию кислорода
По летучести
По
растворимости
Слайд 10Свойство кислот изменять цвет индикатора

Слайд 11Уравнения диссоциации кислот
HCl H+ + Cl- ДИССОЦИАЦИЯ
СИЛЬНЫХ
H2SO4 H+ +HSO4- КИСЛОТ
HSO4- H+

+SO42-
H2O +CO2 H2CO3 H+ +HCO3-
ДИССОЦИАЦИЯ СЛАБОЙ КИСЛОТЫ
Слайд 12Техника безопасности на уроках химии
Все опыты нужно проводить строго на поддоне
2) Запрещается

пробовать на вкус любые вещества.
3) В процессе работы необходимо следить, чтобы химические реактивы не попадали на кожу лица и рук. Если это произошло, необходимо промыть поверхность большим количеством воды и обработать раствором соды (в случае попадания кислоты) или раствором борной кислоты (в случае попадания щелочи).
4) Растворы необходимо наливать из сосудов так, чтобы при наклоне этикетка оказывалась сверху (этикетку — в ладонь!).
5) Твердые сыпучие реактивы разрешается брать из склянок только с помощью совочков, ложечек, шпателей, пробирок.
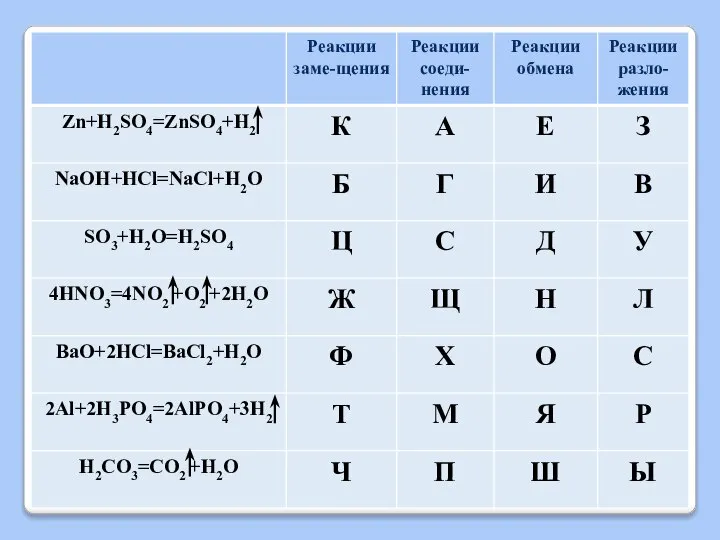
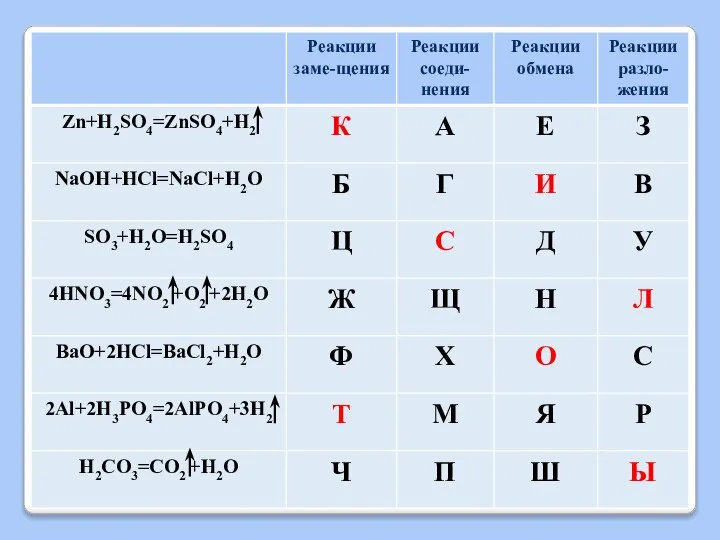
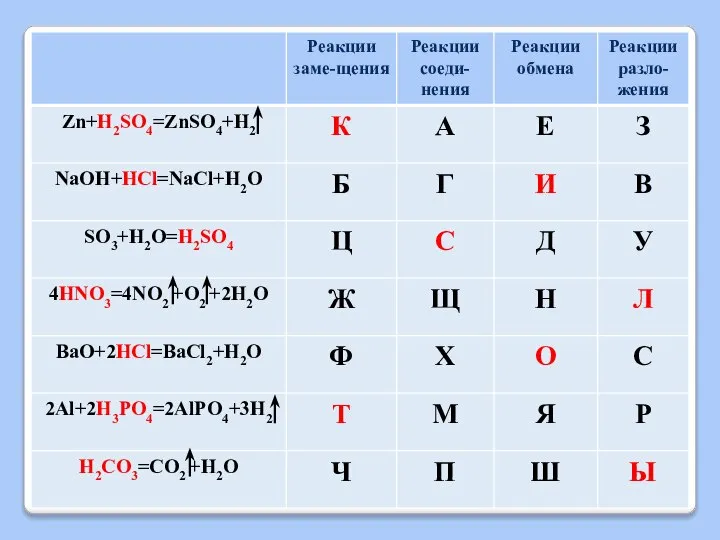
Слайд 13ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
2) Взаимодействие с активными металлами
Кислота + Металл = Соль +

Н2
Слайд 14ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
2) Взаимодействие с активными металлами
Кислота + Металл = Соль +

Н2
1) Zn + 2HCl = ZnCl2 +H2
2) Mg + H2SO4 = MgSO4 + H2
3)Cu + HCl =
Слайд 15ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
3) Взаимодействие с основными оксидами
Кислота + Основный оксид = Соль

+ Н2О
Слайд 16ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
3) Взаимодействие с основными оксидами
Кислота + Основный оксид = Соль

+ Н2О
1) CuO + 2HCl = CuCl2 + H2O
CuO + 2H+ + 2Cl- =Cu 2+ +2Cl- + H2O
CuO + 2H+ = Cu 2+ + H2O
2) ) CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ + SO4 2- =Cu 2+ +SO4 2- + H2O
CuO + 2H+ = Cu 2+ + H2O
Слайд 17ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
4) Взаимодействие с основаниями
(реакция НЕЙТРАЛИЗАЦИИ)
Кислота + Основание = Соль

+ Н2О
Слайд 18ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
4) Взаимодействие с основаниями
(реакция НЕЙТРАЛИЗАЦИИ)
Кислота + Основание = Соль

+ Н2О
1) 2NaOH + H2SO4 = Na2SO4 + 2H2O
2Na+ +2OH- + 2H+ + SO4 2- = 2Na+ +SO4 2- + 2H2O
2OH- + 2H+ = 2H2O
2) CuSO4 +2NaOH = Na2SO4 + Cu(OH)2
Cu 2+ +SO4 2- + 2Na+ +2OH- = 2Na+ +SO4 2- + Cu(OH)2
Cu 2+ + 2OH- = Cu(OH)2
3) Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ + 2Cl- =Cu 2+ +2Cl- + 2H2O
Cu(OH)2 + 2H+ =Cu 2+ + 2H2O
Слайд 19ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
5) Взаимодействие с солями
Кислота + Соль = новая Соль

+ новая Кислота
Слайд 20ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
5) Взаимодействие с солями
1) Na2CO3 + H2SO4 = Na2SO4 +

CO2 + H2O
2Na+ +CO3 2- + 2H+ + SO4 2- = 2Na+ +SO4 2- + CO2 + 2H2O
CO3 2- + 2H+ = CO2 + 2H2O
2) Na2SiO3 + 2HCl = 2NaCl + H2SiO3
2Na+ +SiO3 2- + 2H+ + 2Cl- =2Na+ +2Cl- + H2SiO3
SiO3 2- + 2H+ = H2SiO3
Слайд 25Подведем итоги:
- Я узнал на уроке, что…
- Меня удивило…
-

Я затруднился…
- У меня не получилось…
Слайд 26
Домашнее задание:
П.38, № 4,5
стр. 214



















 Электрохимия
Электрохимия Реакции ионного обмена
Реакции ионного обмена pervonachalnye_svedenia_ob_org_v-kh
pervonachalnye_svedenia_ob_org_v-kh Хим_10_30_Производство_аммиака
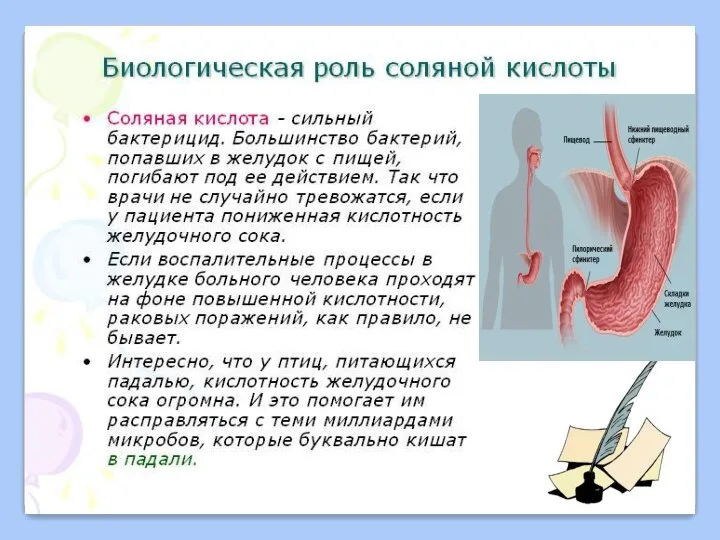
Хим_10_30_Производство_аммиака Кислоты. Свойства кислот
Кислоты. Свойства кислот Фенолы
Фенолы Алкены. Строение
Алкены. Строение Основания
Основания Органические вещества
Органические вещества Простые вещества – металлы. Общие физические свойства металлов
Простые вещества – металлы. Общие физические свойства металлов Образование дипептида
Образование дипептида Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Висмут Bi
Висмут Bi Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора
Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора Spectroscopy. U.V. Lect.2
Spectroscopy. U.V. Lect.2 Дизайн молекулярных магнетиков
Дизайн молекулярных магнетиков Физическое явление в химии
Физическое явление в химии Соединения азота
Соединения азота Газовые законы
Газовые законы Химические явления. Закон сохранения массы веществ
Химические явления. Закон сохранения массы веществ Интересные свойства пластика
Интересные свойства пластика ЛКМ на основе кремнийорганических соединений
ЛКМ на основе кремнийорганических соединений Азот
Азот Химический опыт с горением борноэтилового эфира
Химический опыт с горением борноэтилового эфира Презентация на тему Значение Периодического закона Д.И.Менделеева
Презентация на тему Значение Периодического закона Д.И.Менделеева  Алканы 10-класс
Алканы 10-класс Енергетика хімічних реакцій
Енергетика хімічних реакцій Презентация на тему Витамины. Урок химии 10 класс
Презентация на тему Витамины. Урок химии 10 класс