Содержание
- 2. Химическая термодинамика. Термодинамические потенциалы. Термодинамические потенциалы или характеристические функции – термодинамические функции, посредством которых и их
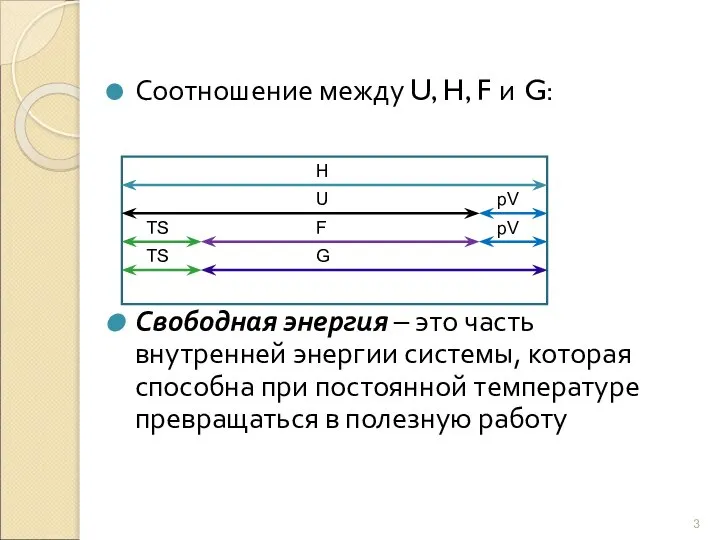
- 3. Соотношение между U, H, F и G: Свободная энергия – это часть внутренней энергии системы, которая
- 4. Теплосодержание системы ΔH = ΔG + TΔS ΔG – свободная энергия Гиббса, часть теплоты, которая может
- 5. Самопроизвольное протекание изохорно-изотермического процесса определяется энергией Гельмгольца (часть внутренней энергии, которую можно перевести в работу) ∆F
- 6. Основное уравнение термодинамики Описывает зависимость термодинамических потенциалов от их естественных переменных Объединяет первое и второе начала
- 7. Если в системе происходит химическая реакция или система открыта (т.е. обменивается с окружающей средой веществом и
- 8. Химический потенциал характеризует приращение соответствующего термодинамического потенциала при изменении количества данного вещества при фиксированных естественных переменных
- 9. Смысл термодинамических потенциалов: зная любой из четырех потенциалов как функцию естественных переменных, можно с помощью основного
- 10. Любой термодинамический потенциал в необратимых самопроизвольных процессах, протекающих при постоянстве естественных переменных, уменьшается и достигает минимума
- 11. В химических процессах одновременно изменяются энтальпия (энергетический запас системы) и энтропия (не совершающая работу энергия). Анализ
- 12. По определению энергия Гиббса G = H – TS Если продукты реакции и исходные вещества находятся
- 13. Изотермический равновесный процесс без затраты внешних сил может протекать самопроизвольно только в направлении убывания энергии Гиббса
- 14. Стандартная энергия Гиббса (при р=1 бар и Т=298К) Большинство процессов протекает при температурах более высоких, чем
- 16. Скачать презентацию












 Подгруппа кислорода. Решение экспериментальных задач
Подгруппа кислорода. Решение экспериментальных задач Синтетические материалы
Синтетические материалы Химия и производство
Химия и производство Реакция полимеризации
Реакция полимеризации Презентация на тему Нанохимия
Презентация на тему Нанохимия  Жизнь и деятельность Д.И.Менделеева «Если не будешь знать имен, то умрет и познание вещей» К.Линей. Автор: Ватитова А.А. МОУ Еласов
Жизнь и деятельность Д.И.Менделеева «Если не будешь знать имен, то умрет и познание вещей» К.Линей. Автор: Ватитова А.А. МОУ Еласов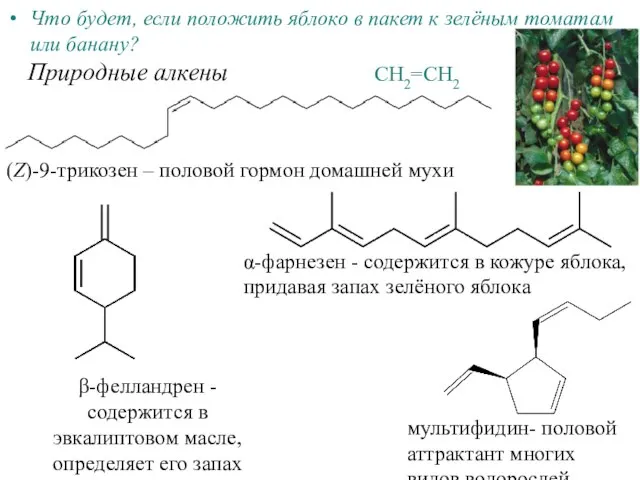 Алкены
Алкены Сплавы цветных металлов
Сплавы цветных металлов Сера. Аллотропия серы. Физические и химические свойства серы. Применение
Сера. Аллотропия серы. Физические и химические свойства серы. Применение Минерал дунит
Минерал дунит Альдегиды, их химические и физические свойства. Получение и применение альдегидов
Альдегиды, их химические и физические свойства. Получение и применение альдегидов Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи
Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи Спирты (10 класс)
Спирты (10 класс) Сера и её соединения
Сера и её соединения Homecredit Bank. Показатели и зоны роста
Homecredit Bank. Показатели и зоны роста Атомы. Нахождение в природе
Атомы. Нахождение в природе Угольная кислота и её соли
Угольная кислота и её соли Ионные уравнения
Ионные уравнения Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона
Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона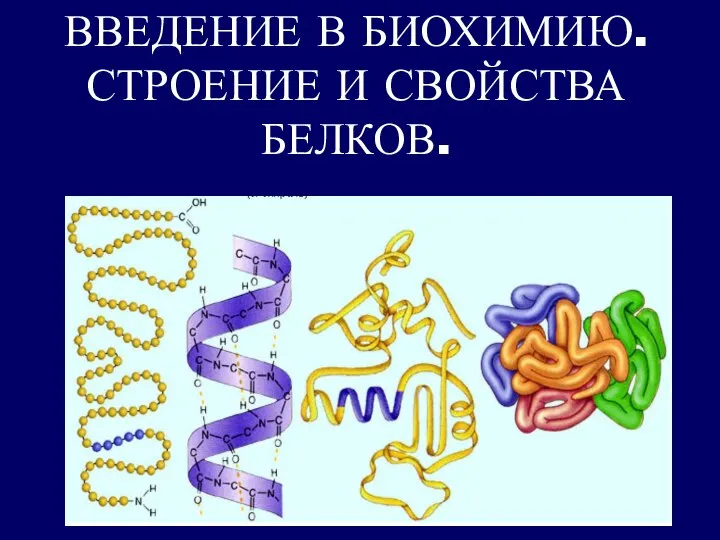 Введение в биохимию. Строение и свойства белков
Введение в биохимию. Строение и свойства белков Область применения карбоновых кислот
Область применения карбоновых кислот Полимеры и пластмассы
Полимеры и пластмассы Строение атома. Распределение электронов
Строение атома. Распределение электронов Лакокрасочные материалы
Лакокрасочные материалы Презентация на тему Cкорость химических реакций
Презентация на тему Cкорость химических реакций  Соли азотной кислоты
Соли азотной кислоты Кислород и сера
Кислород и сера Анилин. Строение и свойства анилина
Анилин. Строение и свойства анилина