Слайд 2Общая характеристика Общая характеристика VI-Общая характеристика VI-а подгруппы
Сера
Сероводород и сульфиды
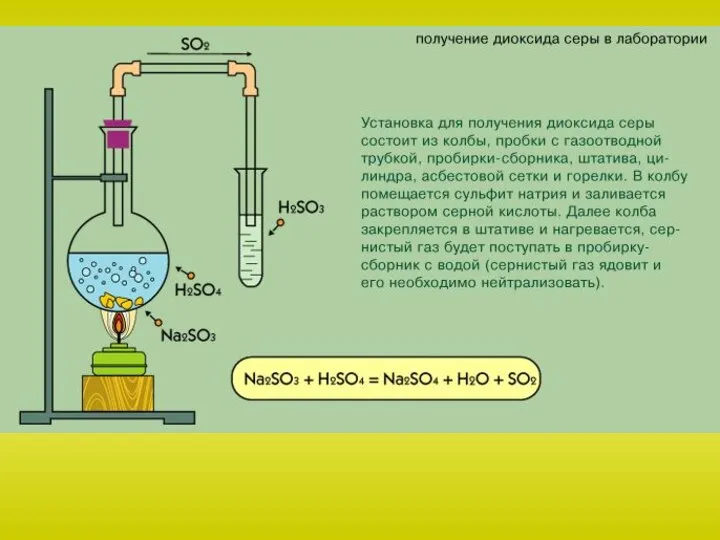
Оксиды серы
Оксид серы

(Оксид серы (IV)
Оксид серы (Оксид серы (VI)
Сернистая кислота
Серная кислота
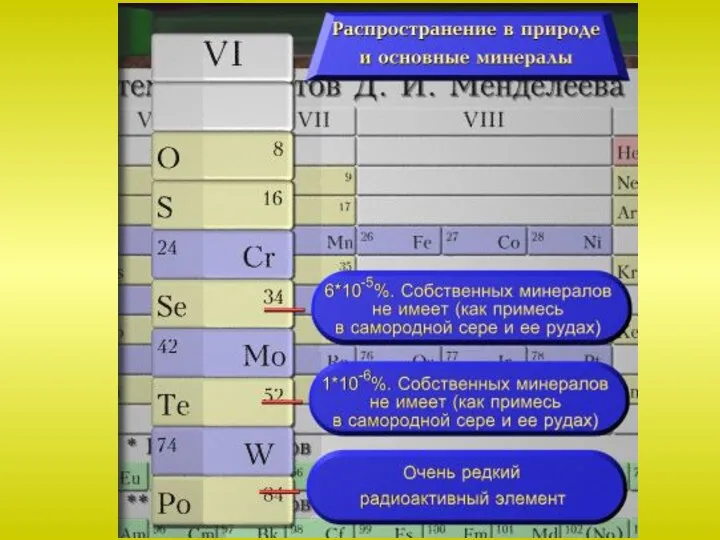
Слайд 3Общая характеристика VI-а подгруппы

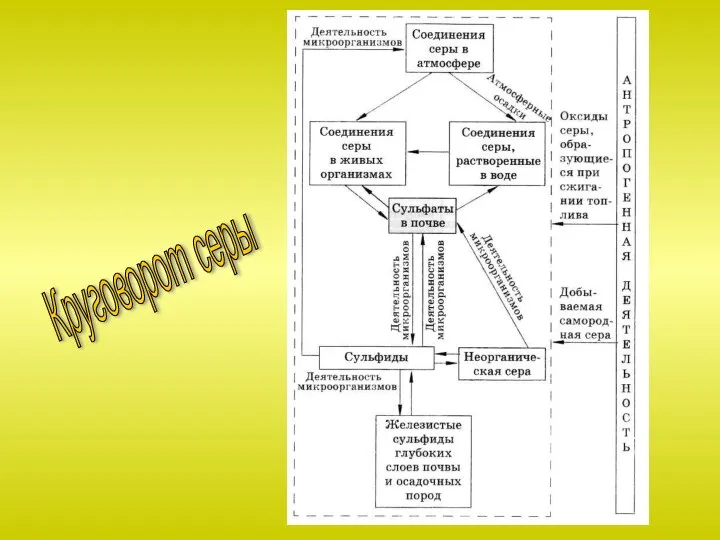
Слайд 13Сера известна с давних времен. В природе встречается в свободном и связанном

виде. Общее содержание серы по массе в земной коре составляет около 0,1% или 0,7% массы планеты. Главная масса серы в виде сульфидов металлов находится в мантии Земли на глубине 1100-1400 км.
Слайд 14Известно несколько аллотропных модификаций серы. До температуры 150°C молекула серы имеет циклическую

форму. Это кольцо из 8 атомов, соединенных в виде короны. В обычных условиях это кристаллы так называемой ромбической модификации. При повышении температуры до 100°С она превращается в моноклинную. Расплавленная сера при 187°C становится очень вязкой, кольца S8 разрываются и происходит полимеризация в виде спиральных молекул с длиной цепи до 10 000 атомов. При дальнейшем нагревании эти молекулы разрываются и вязкость уменьшается. Охлаждая такой расплав атомы серы образуют пластическую серу, которая через некоторое время переходит в кристаллическую ромбическую модификацию.
Слайд 16В воде сера не растворяется (всплывает), растворима в органических растворителях. Диэлектрик.

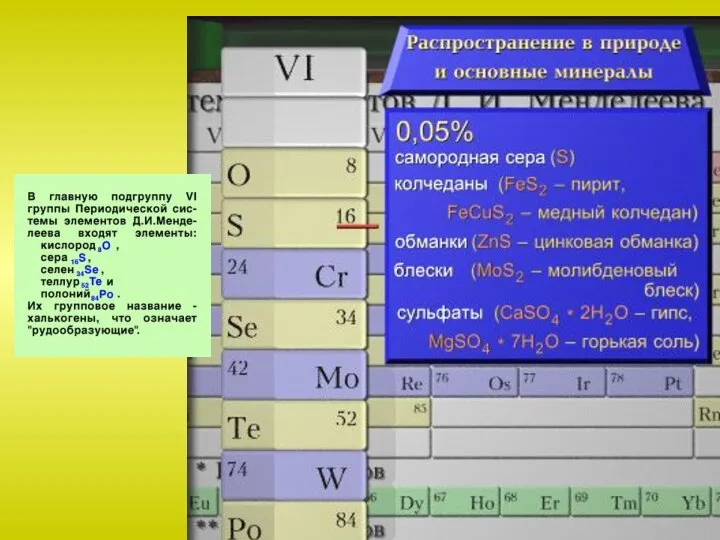
Слайд 17Элементы подгруппы кислорода в значительной мере отличаются от кислорода, прежде всего в

способности проявлять положительные степени окисления. На внешнем электронном слое у атома серы шесть электронов. Формула электронной конфигурации 3s23p4. Взаимодействуя с менее электроотрицательными элементами сера может принимать 2 электрона, проявляя степень окисления –2. Также сера способна отдавать электроны, проявляя степень окисления от +2 до +6, причем только в соединениях с кислородом и некоторыми галогенами.
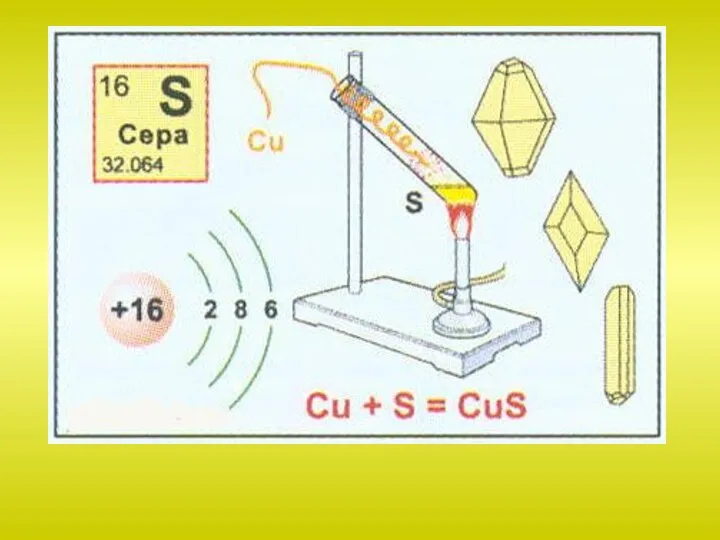
Слайд 18Сера – активный неметалл. Среди металлов только золото, платина и рутений не
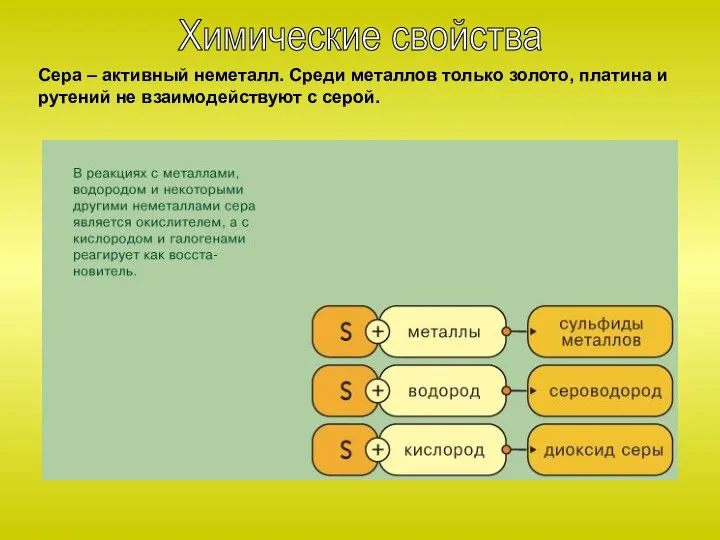
взаимодействуют с серой.
Химические свойства
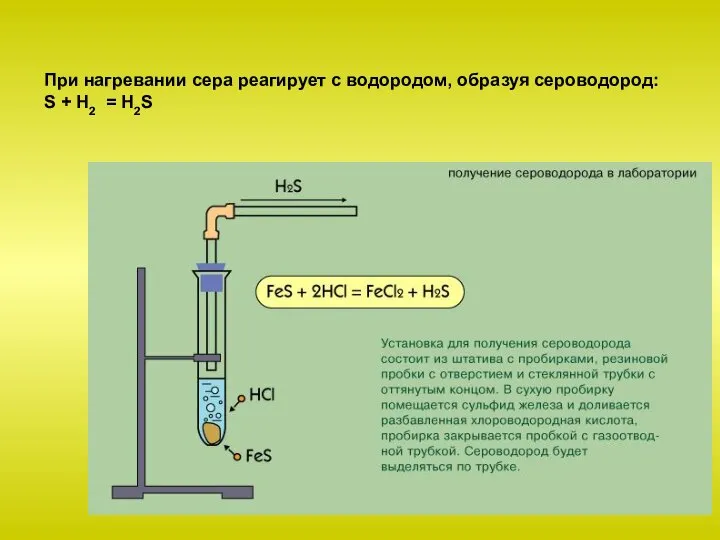
Слайд 19При нагревании сера реагирует с водородом, образуя сероводород:
S + Н2 = H2S
Слайд 20Сера взаимодействует со многими металлами, образуя сульфиды:
S + Fe = FeS
2Al +

3S = Al2S3
Слайд 21Из неметаллов только азот и йод не соединяются с серой. Сжигание серы

в струе кислорода приводит к образованию сернистого газа или сернистого ангидрида SO2:
S + O2 = SO2
Элементарная сера может также проявлять восстановительные свойства:
S + 2HNO3 = H2SO4 + 2NO
Слайд 23Сера используется при вулканизации каучука, приготовления черного пороха, спичек, ядохимикатов, для получения

серной кислоты.
Слайд 37Как кислотный оксид взаимодействует с основными оксидами, основаниями, водой:













































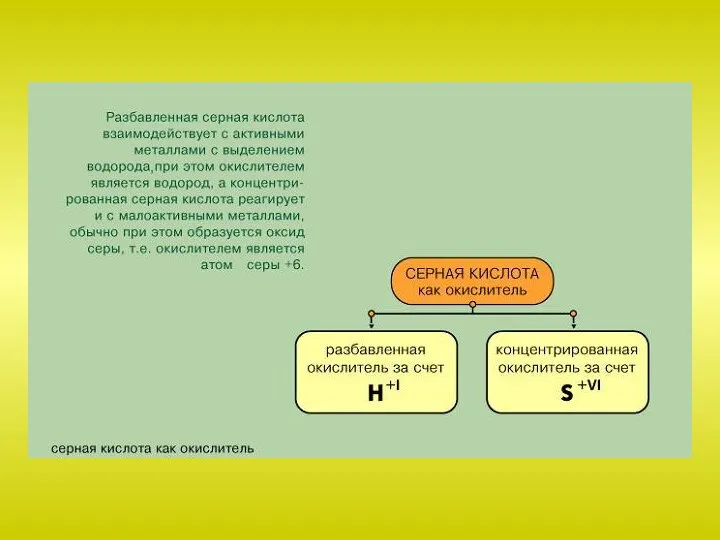

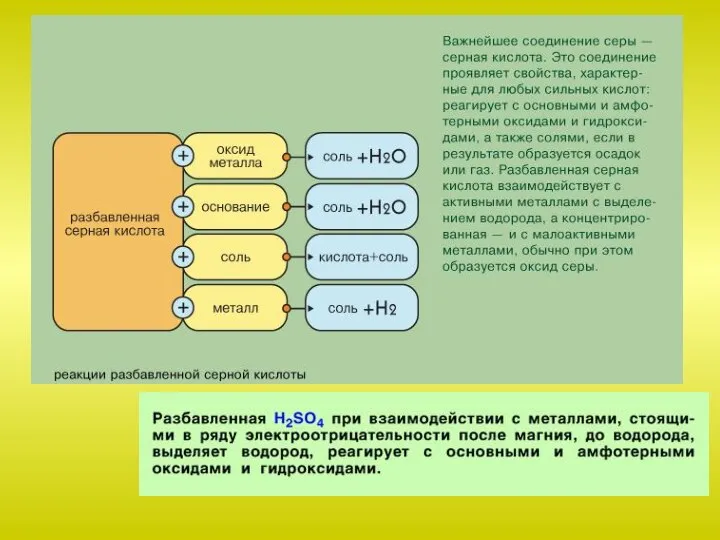




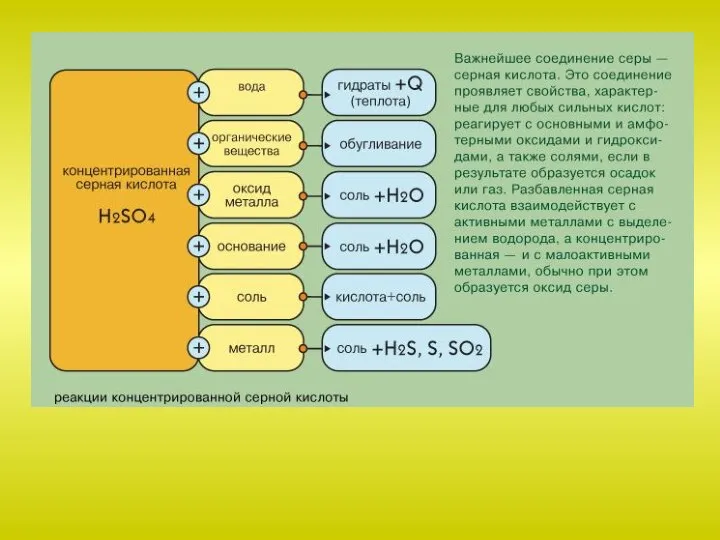
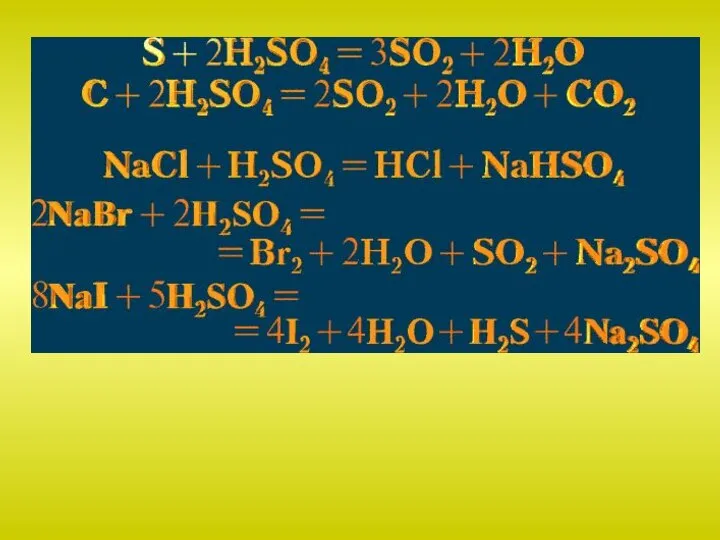

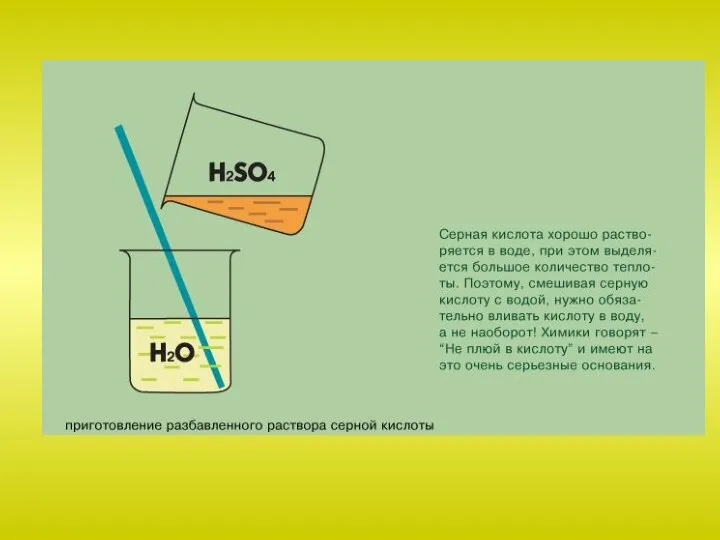

 kisloty
kisloty Биохимия крови
Биохимия крови 596550
596550 Получение и применение алкадиенов
Получение и применение алкадиенов Молярный объем газов
Молярный объем газов Способы получения металлов
Способы получения металлов Спирт – это жизненная необходимость или страшное зло…
Спирт – это жизненная необходимость или страшное зло… Пространственная изомерия органических соединений
Пространственная изомерия органических соединений Подготовка проб товаров к анализу. Химико-аналитический контроль
Подготовка проб товаров к анализу. Химико-аналитический контроль Полистерол Прохоренко Е.О. 11 Б
Полистерол Прохоренко Е.О. 11 Б Оксид серы (VI) SO3
Оксид серы (VI) SO3 Физико-химические свойства нефтепродуктов
Физико-химические свойства нефтепродуктов Природные источники углеводородов
Природные источники углеводородов Аммиак. Соли аммония
Аммиак. Соли аммония Получение металлов
Получение металлов Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Презентация на тему: Азотная кислота
Презентация на тему: Азотная кислота Техника безопасности на уроках химии
Техника безопасности на уроках химии Искусственные полимеры
Искусственные полимеры Хлорорганические соединения
Хлорорганические соединения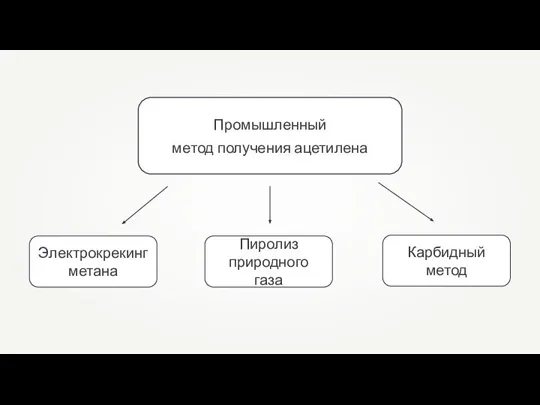 Промышленный метод получения ацетилена
Промышленный метод получения ацетилена Чистые вещества и смеси
Чистые вещества и смеси Дисперсные системы. Гели
Дисперсные системы. Гели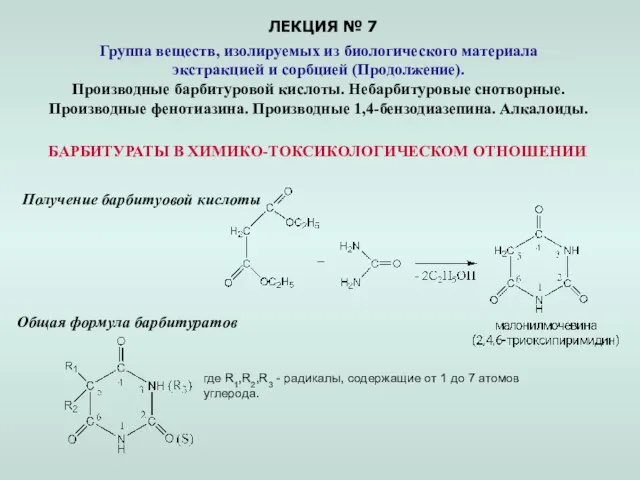 Презентация по Химии "Группа веществ, изолируемых из биологического материала экстракцией и сорбцией"
Презентация по Химии "Группа веществ, изолируемых из биологического материала экстракцией и сорбцией"  Химия и сельское хозяйство
Химия и сельское хозяйство Презентация на тему Скорость химических реакций
Презентация на тему Скорость химических реакций  Буферные системы
Буферные системы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции