Содержание
- 2. Химические явления – превращение одних веществ в другие Ржавление железа Скисание молока Гниение листьев Процесс фотосинтеза
- 3. Признаки химических реакций Выпадение осадка Выделение газа Появление запаха Выделение или поглощение теплоты Появление света Изменение
- 4. Реакция никеля с соляной кислотой Признак реакции – изменение цвета Сульфид натрия с соляной кислотой Признак
- 5. Йодид калия с нитратом свинца (II) Признак реакции – выпадение осадка Кусочек мела в соляной кислоте
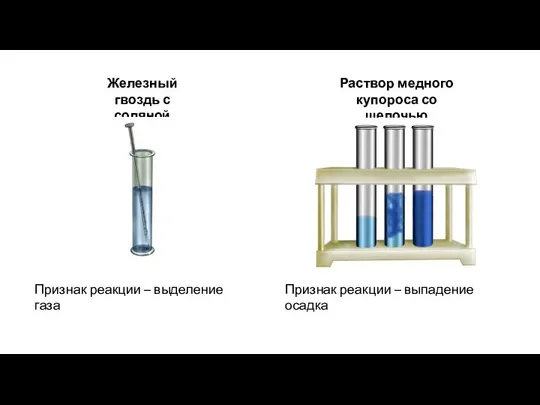
- 6. Железный гвоздь с соляной кислотой Признак реакции – выделение газа Раствор медного купороса со щелочью Признак
- 7. FeS Серого цвета Тонет в воде Не притягивается магнитом
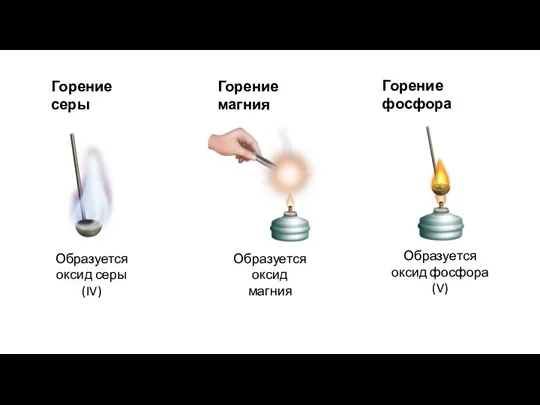
- 8. Горение серы Горение магния Горение фосфора Образуется оксид серы (IV) Образуется оксид магния Образуется оксид фосфора
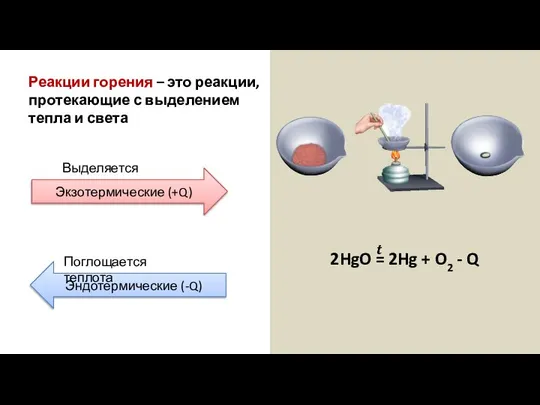
- 9. Реакции горения – это реакции, протекающие с выделением тепла и света Выделяется теплота Экзотермические (+Q) Эндотермические
- 10. Условия протекания химических реакций Соприкосновение реагирующих веществ Нагревание для определенных реакций Свет или электрический ток в
- 11. В 1748 году открыт ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ М.В. Ломоносов Атомы не разрушаются и не образуются,
- 12. Подтверждение закона сохранения массы веществ ЗНАЧЕНИЕ закона сохранения массы веществ Развитие химии как науки. На основании
- 13. Химическое уравнение – условная запись химической реакции с помощью химических формул и знаков А + Б
- 14. Молекулярное уравнение – это уравнение, в котором исходные вещества и продукты реакции записаны в виде молекул
- 15. ПРОВЕРКА Д/3 (из видео – прошлый урок!!!)
- 16. ПРОВЕРКА Д/3 (из видео – прошлый урок!!!)
- 18. Скачать презентацию












 Классификация спиртов. Изомерия спиртов
Классификация спиртов. Изомерия спиртов Электрохимия. Электролиты
Электрохимия. Электролиты Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания
Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания Презентация на тему Валентность и степень окисления (8 класс)
Презентация на тему Валентность и степень окисления (8 класс)  Пусть имя Д.И. Менделеева будет нашей путеводной звездой
Пусть имя Д.И. Менделеева будет нашей путеводной звездой Анилин. Строение и свойства анилина
Анилин. Строение и свойства анилина Окислительно=восстановительное титрование
Окислительно=восстановительное титрование Алкины
Алкины Строение и химический состав костей, рост костей
Строение и химический состав костей, рост костей Презентация на тему Серная кислота (9 класс)
Презентация на тему Серная кислота (9 класс)  Электрохимия. Экзаменационные вопросы
Электрохимия. Экзаменационные вопросы Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Современные области применения изотопной продукции
Современные области применения изотопной продукции Прикладная геохимия
Прикладная геохимия Презентация на тему "Азотная кислота"
Презентация на тему "Азотная кислота" Кислоты, соли
Кислоты, соли Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Природные источники углеводородов
Природные источники углеводородов Предельные углеводороды. Тест 19
Предельные углеводороды. Тест 19 Нефть
Нефть Судың химиялық потенциялы
Судың химиялық потенциялы Соли
Соли Получение меди
Получение меди Кинетика химических реакций
Кинетика химических реакций Массовая доля выхода продукта реакции от теоретически возможного
Массовая доля выхода продукта реакции от теоретически возможного Типы химических реакций
Типы химических реакций Дисперсные системы. Лекция №7
Дисперсные системы. Лекция №7 Электролитическая диссоциация
Электролитическая диссоциация