Содержание
- 2. Лек.-сем. № 4. КВАНТОВЫЕ ЧИСЛА Главное квантовое число n характеризует общую энергию электрона в атоме. Оно
- 3. Лек.-сем. № 4. КВАНТОВЫЕ ЧИСЛА Магнитное квантовое число ml характеризует пространственное расположение орбиталей (облаков). Оно может
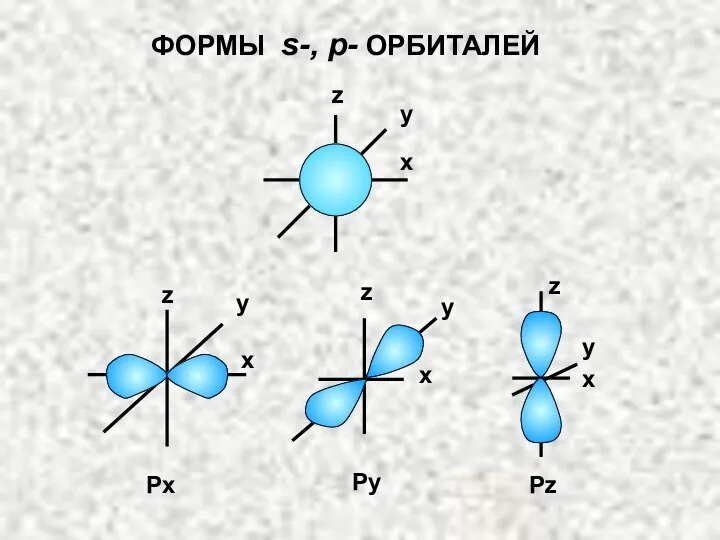
- 4. ФОРМЫ s-, p- ОРБИТАЛЕЙ x x x x y z Px Py Pz y y y
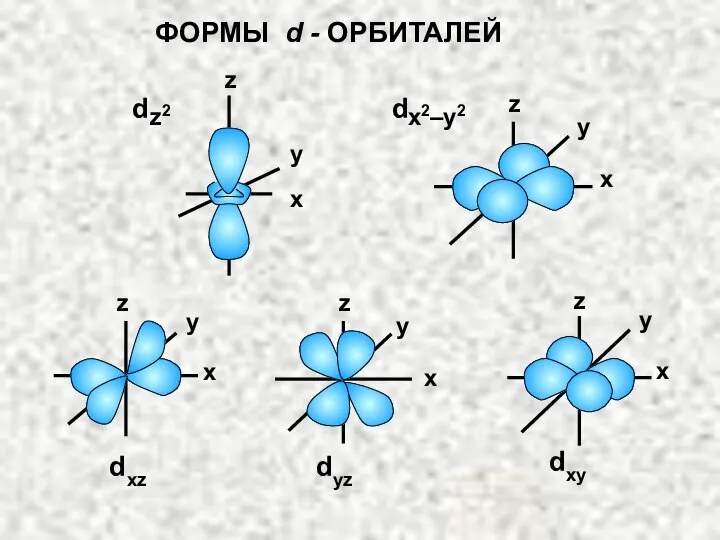
- 5. z2 x2–y2 dxy x y z x y z x y z x y z x
- 6. Согласно принципу Паули, в атоме не может быть двух электронов, характеризующихся одинаковым набором квантовых чисел. Из
- 7. Устойчивому (невозбужденному) состоянию много-электронного атома отвечает такое распределение электронов по АО, при котором энергия атома минимальна.
- 8. Согласно этим правилам, АО заполняются электронами в порядке последовательного увеличения суммы n + l (1-е п
- 9. Пример 1. Какой подуровень заполняется в атоме электронами после заполнения подуровня 4р? ПРАВИЛА КЛЕЧКОВСКОГО
- 10. Р е ш е н и е 1. Подуровню 4р отвечает сумма n + l, равная
- 11. Размещение электронов по АО в пределах одного энергетического подуровня определяется п р а в и л
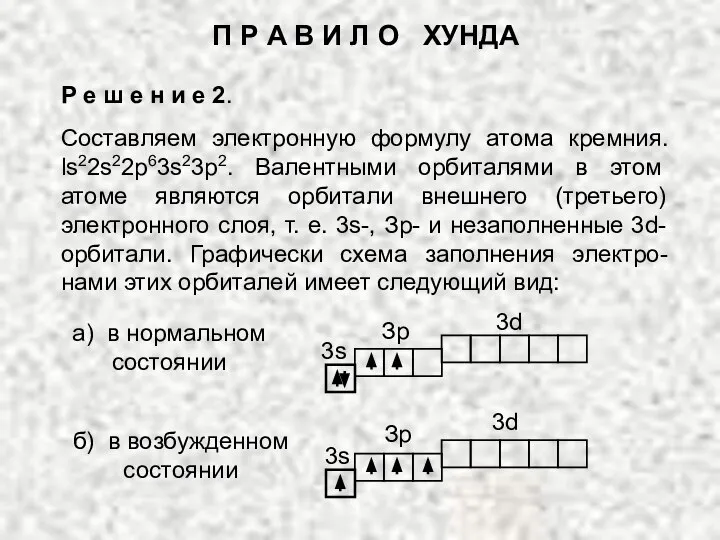
- 12. Р е ш е н и е 2. Составляем электронную формулу атома кремния. ls22s22p63s23p2. Валентными орбиталями
- 13. В электронных формулах буквами s, p, d, f обозначаются энергетические подуровни. Цифры впереди букв означают энергетический
- 14. При составлении электронной формулы атома любого элемента нужно руководствоваться следую-щей последовательностью: 1. Определить порядковый номер элемента
- 16. В зависимости от того, какой подуровень заполня-ется электронами, все элементы делятся на четыре типа (семейства): 1)
- 17. 3) d – элементы: у них заполняется d- подуровень второго снаружи уровня. Их общая формула: …
- 18. 1. s – элементы … ns1-2 2. p – элементы … ns2 n р1–6 3. d
- 19. Составление электронных конфигураций атомов без помощи таблицы Менделеева Для этого нужно знать: 1. Сколько элементов содержится
- 20. 2. Что первые два элемента в периоде- это S-элементы. 3. Последние шесть элементов каждого периода (кроме
- 21. Решение: 1) Определим в каком периоде находится элемент: 18 2) Определим какой по счету он в
- 22. Пример 3. Имеется ли d-подуровень на втором энергетическом уровне? Пример 4. Почему число АО на L-уровне
- 23. Решение 3. Нет, так как для d-подуровня l = 2, что возможно только для значений n
- 24. Пример 5. Каково максимальное число ориентаций f-орбиталей в пространстве? Пример 6. Возможно ли наличие в атоме
- 25. Решение 5. Так как при l = 3 (f-подуровень) имеется семь значений квантового числа ml =
- 26. Пример 7. Запишите электронную конфигу-рацию двухзарядного положительного иона олова Sn2+ и четырехзарядного Sn4+. Как соотносятся энергии
- 27. Решение 7. Электронная конфигурация атома олова Sn — [Kr]4d105s25p2, так как олово расположено в 5 периоде
- 29. Скачать презентацию





















![Решение 7. Электронная конфигурация атома олова Sn — [Kr]4d105s25p2, так как олово](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/933709/slide-26.jpg)
 Алюминий
Алюминий Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами
Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Циклоалканы
Циклоалканы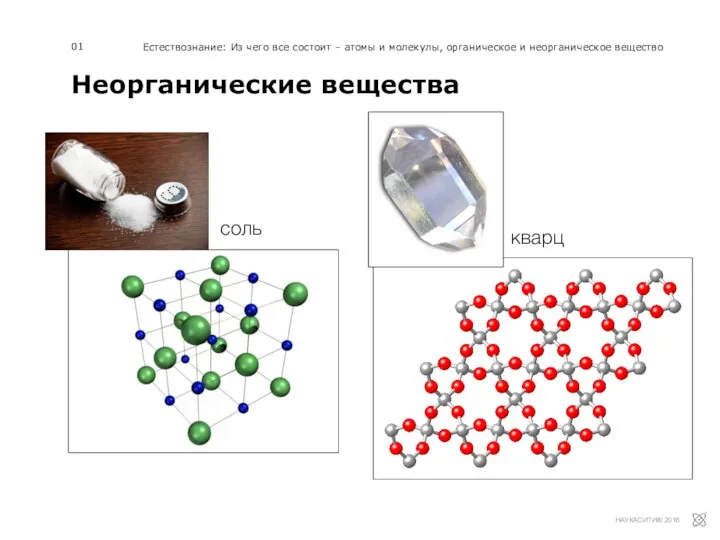 Неорганические вещества
Неорганические вещества Непредельные углеводороды: алкены и алкины
Непредельные углеводороды: алкены и алкины Висмут Bi
Висмут Bi Нітратна кислота Презентація вчителя хімії Смілянської загальноосвітньої школи І-ІІІ ст. № 11 Л.В.Заруби
Нітратна кислота Презентація вчителя хімії Смілянської загальноосвітньої школи І-ІІІ ст. № 11 Л.В.Заруби Нуклеиновые кислоты (НК)
Нуклеиновые кислоты (НК) Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"
Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"  Углеводороды в природе
Углеводороды в природе Применение углерода
Применение углерода Магний для растений
Магний для растений Презентация на тему Изомерия
Презентация на тему Изомерия  热塑性复合材料的分类及特性
热塑性复合材料的分类及特性 Состояние электронов в атоме
Состояние электронов в атоме Изомерия
Изомерия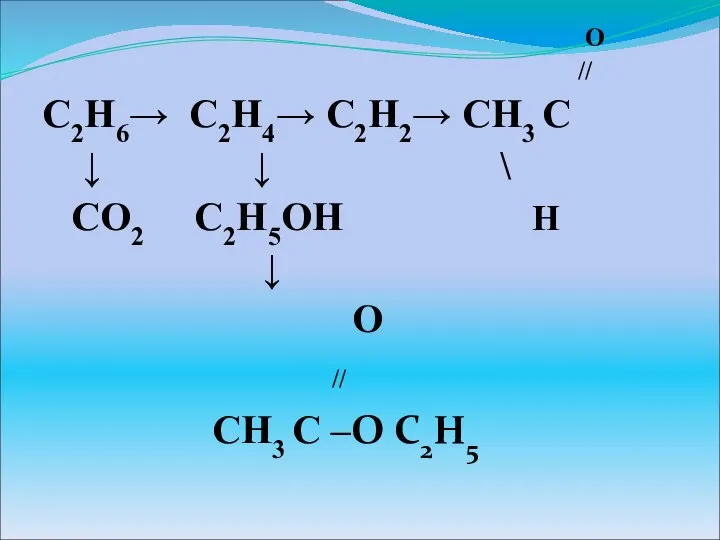 Органические соединения
Органические соединения Характеристика нефти и ее фракций как сырья для производства мoторныx топлив. Тема 2
Характеристика нефти и ее фракций как сырья для производства мoторныx топлив. Тема 2 Учебное задание Расчет теплоты сгорания
Учебное задание Расчет теплоты сгорания Карбоновые кислоты
Карбоновые кислоты proekt_TTU_15 (1)
proekt_TTU_15 (1) Оксиды, получение и свойства
Оксиды, получение и свойства Презентация по Химии "Получение уксусной кислоты и опыты с ней"
Презентация по Химии "Получение уксусной кислоты и опыты с ней"  Металлы. Общая характеристика ( 9 класс)
Металлы. Общая характеристика ( 9 класс) Циклические эфиры (окиси)
Циклические эфиры (окиси) Влияние давления на процессы абсорбция и деборция
Влияние давления на процессы абсорбция и деборция Азот в сельском хозяйстве
Азот в сельском хозяйстве