Слайд 2Каковы особенности строения атомов металлов?
Атомы металлов имеют сравнительно большие атомные радиусы,
поэтому

их внешние электроны значительно удалены от ядра и слабо с ним связаны.
Наличие 1-3 электронов на внешнем энергетическом уровне (у атомов наиболее активных металлов).
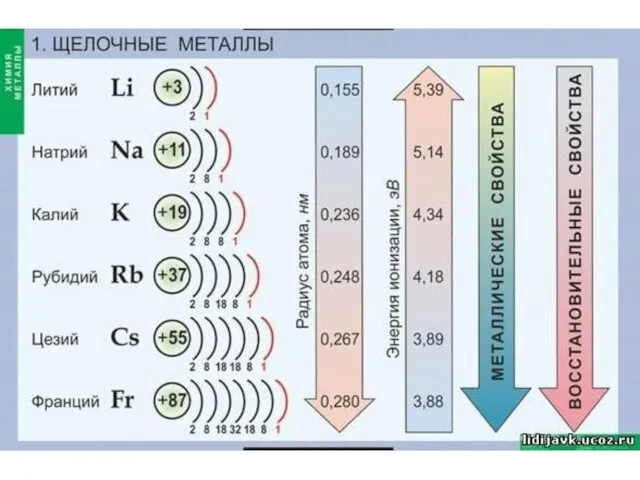
Слайд 3Щелочные металлы:
литий, натрий, калий, рубидий, цезий, франций.
Почему данные металлы назвали щелочными?
При взаимодействии

с водой они образуют растворимые в воде основания – щелочи.
Где располагаются щелочные металлы в ПСХЭ Д.И. Менделеева?
Почему данные металлы Д.И. Менделеев объединил в одну группу?
Слайд 5Физические свойства ЩМ:
серебристо-белые (кроме цезия);
легкие;
легкоплавкие;
мягкие (легко режутся ножом)

Слайд 6Литий
https://www.youtube.com/watch?v=ZTTb-GomRmc

Слайд 7
Натрий
https://www.youtube.com/watch?v=fFuA8XC8tIM

Слайд 8
Калий https://www.youtube.com/watch?v=oEKSJBX-hKA

Слайд 9Рубидий https://www.youtube.com/watch?v=V1-LcbGSsmw&t=36s

Слайд 10Цезий https://www.youtube.com/watch?v=1gh5JJDvdiQ&t=38s

Слайд 11Как особенности строения металлов влияют на их химические свойства?
характерное химическое свойство всех

металлов – их восстановительная способность –
способность атомов легко отдавать свои внешние электроны,
превращаясь в положительные ионы.
Металлы не могут быть окислителями,
т. е. атомы металлов не могут присоединять к себе электроны.
Слайд 12Химические свойства ЩМ
ЩМ легко отдают электроны,
поэтому являются очень сильными восстановителями.
Во

всех соединениях проявляют степень окисления +1.
Слайд 13I. Взаимодействие с неметаллами
1) ЩМ + O2
ЩМ легко реагируют с кислородом,

оксид образует только литий:
4Li + O2 = 2Li2O,
натрий образует пероксид:
2Na + O2 = Na2O2,
калий, рубидий и цезий – надпероксид:
K + O2 = KO2.
Слайд 142) ЩМ + галоген = галогенид
Na + Cl2 =
Взаимодействие с водородом,

серой,
фосфором, углеродом, кремнием
протекает при нагревании:
3) ЩМ + H2 = гидрид: Na + H2 =
4) ЩМ + S = сульфид: K + S =
Слайд 155) ЩМ + P = фосфид: K + P =
6) ЩМ +

Si = силицид:
Cs + Si =
7) ЩМ + N2 = нитрид
c азотом легко реагирует только литий, реакция протекает при комнатной температуре Li + N2 =
Слайд 16II. Взаимодействие ЩМ с водой
ЩМ + H2O = гидроксид ЩМ + H2

Na + H2O =
Слайд 17
Реакция цезия с водой
http://chemistry-chemists.com/N3_2012/U3/img/Cesium_water.ogv

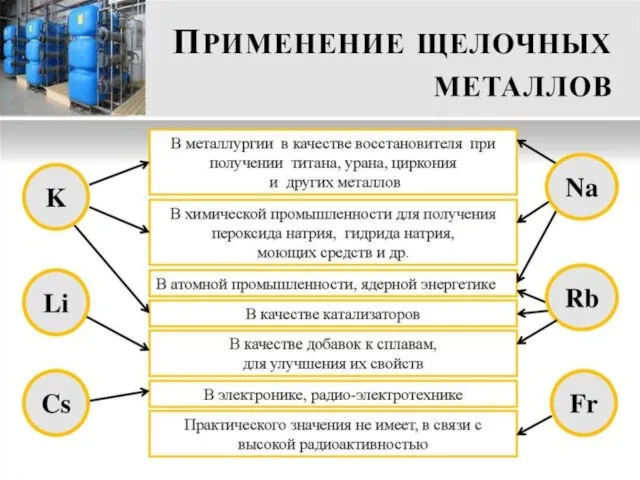
Слайд 18Правила ТБ для работы
со щелочными металлами
работать в вытяжном шкафу
на подносе
сухими руками
брать

в малых количествах

















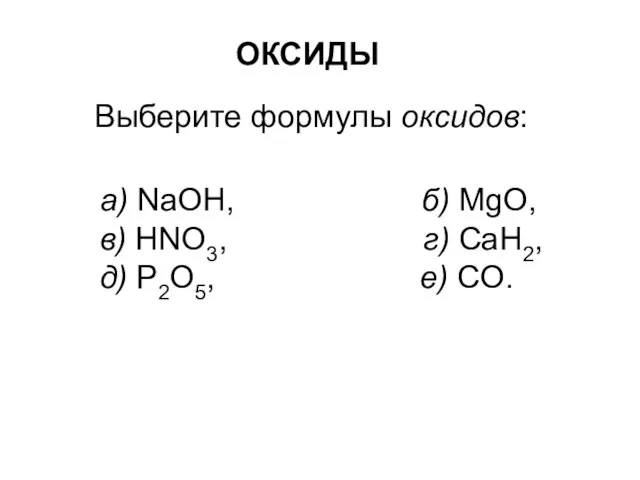 Оксиды
Оксиды Простые вещества - металлы. 8 класс
Простые вещества - металлы. 8 класс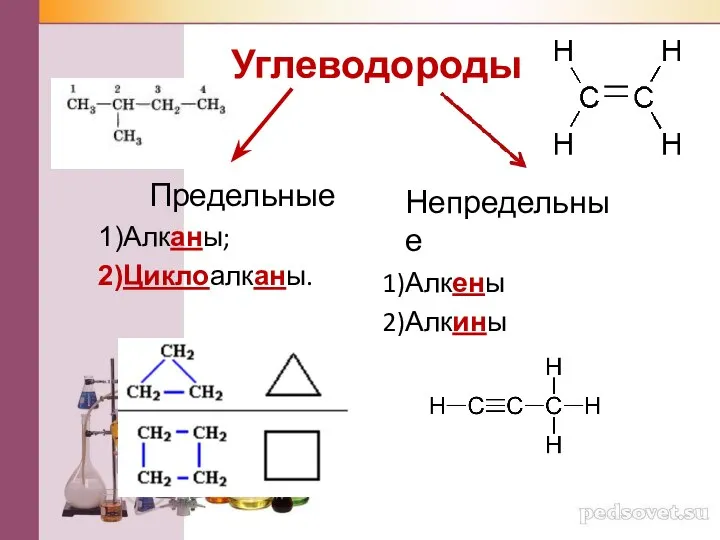 Углеводороды
Углеводороды Химические явления
Химические явления Инструкция по самостоятельной подготовке к ЕГЭ (ЕРЭ) по химии 2022
Инструкция по самостоятельной подготовке к ЕГЭ (ЕРЭ) по химии 2022 Анализ свойств карбамидоформальдегидных смол
Анализ свойств карбамидоформальдегидных смол ПОЛИМЕРНЫЕ МАТЕРИАЛЫ И ТАРА
ПОЛИМЕРНЫЕ МАТЕРИАЛЫ И ТАРА Генетический ряд переходного элемента
Генетический ряд переходного элемента Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Применение брома
Применение брома Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона
Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона Гетероциклические соединения
Гетероциклические соединения Химическая связь
Химическая связь Водород
Водород 10.1С_Серная кислота
10.1С_Серная кислота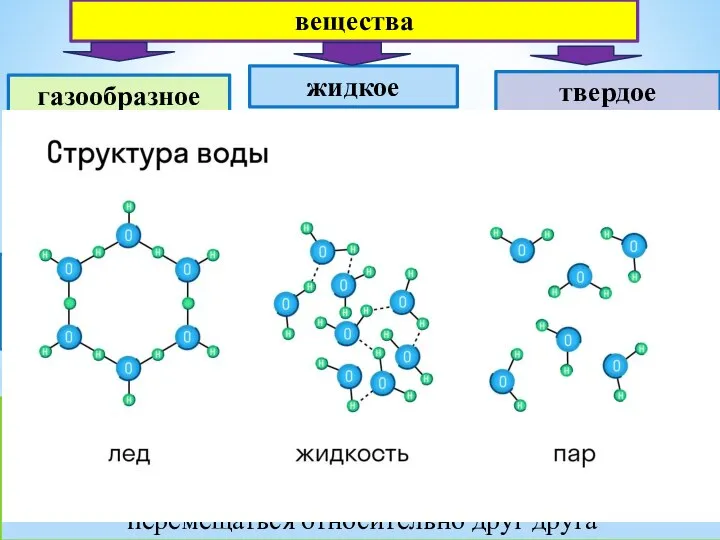 кристал решетка
кристал решетка лекция 1-к.н.с.-ИАИТ-2022
лекция 1-к.н.с.-ИАИТ-2022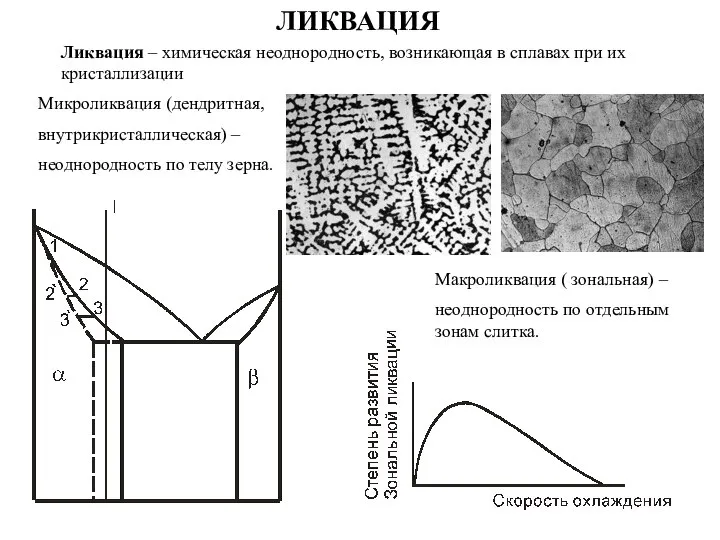 Ликвация. Микроликвация
Ликвация. Микроликвация Алканы. Получение и применение
Алканы. Получение и применение Реакции обмена
Реакции обмена Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Галогены. Обобщение знаний
Галогены. Обобщение знаний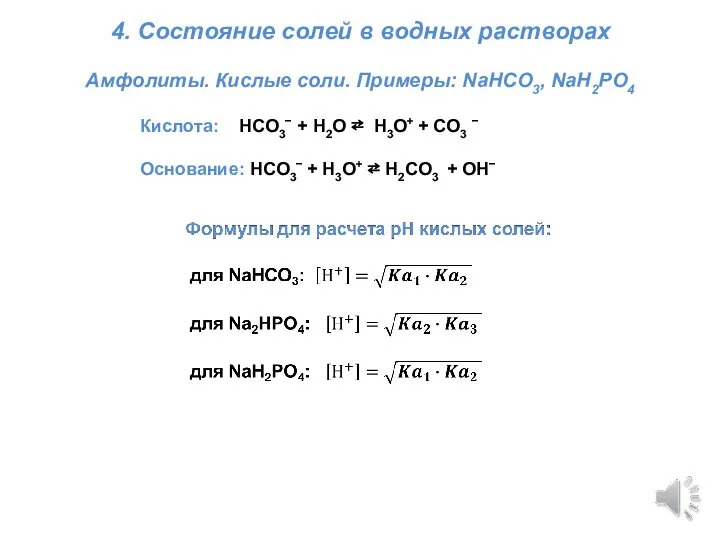 Титриметрия. Состояние солей в водных растворах
Титриметрия. Состояние солей в водных растворах Важнейшие породообразующие минералы
Важнейшие породообразующие минералы Химический опыт Черный сахар
Химический опыт Черный сахар Получение дисперсных систем. Метод конденсации. Метод диспергирования. Эффект Ребиндера. Лекция 11
Получение дисперсных систем. Метод конденсации. Метод диспергирования. Эффект Ребиндера. Лекция 11 Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов
Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов Электролиз. Законы Фарадея
Электролиз. Законы Фарадея