Содержание
- 2. Учебный фильм Перейдите по ссылке: https://yandex.ru/video/search?from=tabbar&text=минеральные%20удобрения%20технология%20производства
- 4. Минеральные удобрения Что это? Минеральные удобрения – это неорганические соединения, содержащие необходимые для жизни растений элементы
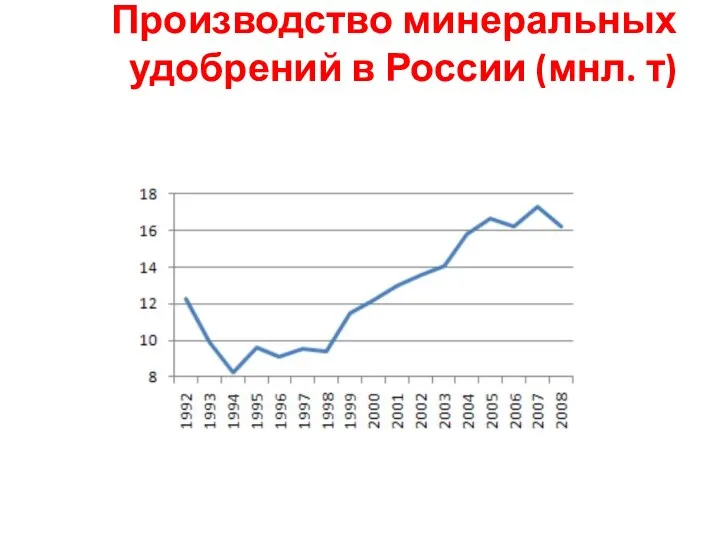
- 5. Производство минеральных удобрений в России (мнл. т)
- 6. Классификации минеральных удобрений По агрохимическому назначению (прямые и косвенные) По составу (простые, комплексные и микроудобрения) По
- 7. По числу компонентов Простые (односторонние) содержат только одно питательное вещество Комплексными (многосторонними) содержат два и более
- 8. Основные виды минеральных удобрений 1 Азотные удобрения 2 Фосфорные удобрения 2.1 Фосфоритная мука 2.2 Суперфосфат 2.3
- 9. Азотные удобрения Отличаются природой связывания азота: Нитратные – селитры, соли азотной кислоты. 2. Амидные – чаще
- 10. Производство аммиачной селитры (нитрата аммония) NH4NO3 https://yandex.ru/video/preview?text=производство%20аммиачной%20селитры%20технологическая%20схема&path=wizard&parent-reqid=1603092001690695-1725644435405037307200107-production-app-host-vla-web-yp-62&wiz_type=vital&filmId=13301618925956843080
- 11. Главными преимуществами нитрата аммония являются: высокое содержание азота – 35 % нахождение азота в аммонийной и
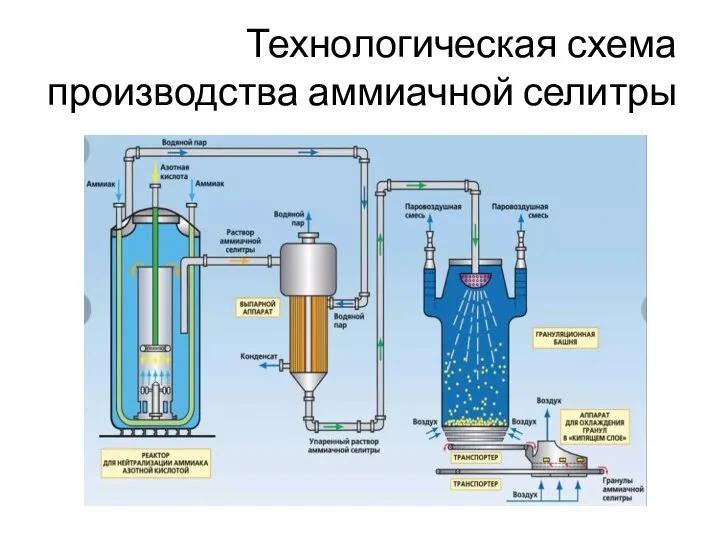
- 12. Технологическая схема производства аммиачной селитры
- 13. Производство карбамида https://yandex.ru/video/preview/?filmId=6930686030926772092&from=tabbar&parent-reqid=1603092703143059-1714146371339800445400107-production-app-host-vla-web-yp-187&text=производство+карбамида+технологическая+схема Карбамид - это бесцветные кристаллы легко растворимые в воде, спирте, жидком аммиаке, сернистом
- 14. Из истории Мочевина открыта Руэлем в 1773 г. и идентифицирована Праутом в 1818 г. Синтез мочевины
- 15. Карбамид В промышленности мочевина синтезируется по реакции Базарова из аммиака и углекислого газа: 2NH3 + CO2
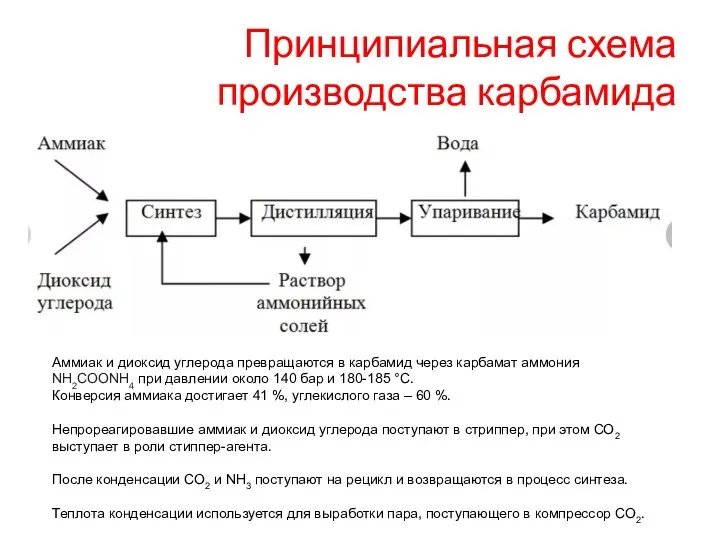
- 16. Принципиальная схема производства карбамида Аммиак и диоксид углерода превращаются в карбамид через карбамат аммония NH2COONH4 при
- 17. Производство фосфорных удобрений Фосфорные удобрения – минеральные удобрения, соли кальция и аммония фосфорной кислоты. К ним
- 18. Из истории До середины XIX века в сельском хозяйстве в качестве фосфорсодержащих удобрений применялись костная мука,
- 19. Простой суперфосфат, смесь Ca(H2PO4)2·H2O и CaSO4 Серый порошок, почти не слёживается, среднерассеиваемый; в удобрении 23—29,5 %
- 20. Двойной суперфосфат, Ca(H2PO4)2·H2O Содержит 45—48 % усвояемой растениями P2O5, очень мало гипса, выпускается преимущественно гранулированным. В
- 21. Производство простого суперфосфата: Сырьем для производства суперфосфата служат природные фосфаты – фосфориты и апатиты и башенная
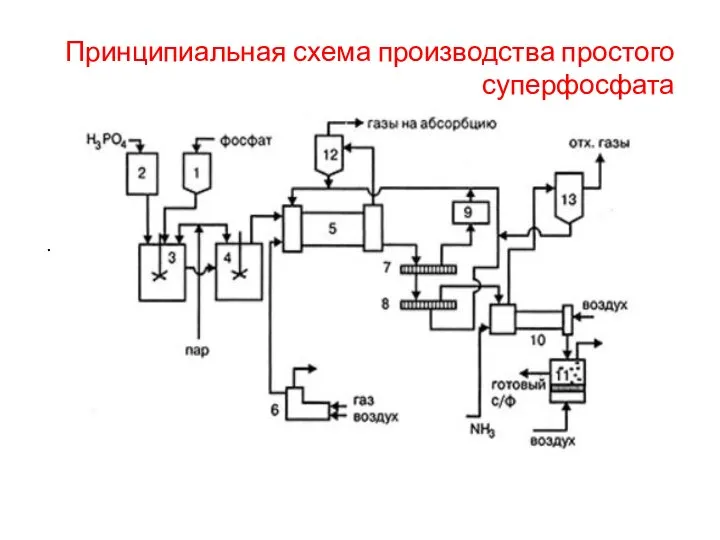
- 22. Принципиальная схема производства простого суперфосфата . .
- 23. Производство двойного суперфосфата Для получения более концентрированного фосфорного удобрения разложение природных фосфатов производят по уравнению реакции
- 25. Скачать презентацию


















 Кабинет химии
Кабинет химии Рубидий (Rb). Цезий (Cs). Франций (Fr)
Рубидий (Rb). Цезий (Cs). Франций (Fr) Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Химическая кинетика и равновесие
Химическая кинетика и равновесие Способы получения металлов
Способы получения металлов Тест по теме Спирты. Фенол
Тест по теме Спирты. Фенол Ионы. Катионы и анионы
Ионы. Катионы и анионы valentnost
valentnost Презентация на тему СПИРТЫ (аканолы, алкоголи)
Презентация на тему СПИРТЫ (аканолы, алкоголи)  Вода как растворитель. Растворы. Растворимость. 8 класс
Вода как растворитель. Растворы. Растворимость. 8 класс Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Драгоценный металл золото
Драгоценный металл золото Атом- сложная частица
Атом- сложная частица Органические вещества
Органические вещества Относительная молекулярная масса вещества
Относительная молекулярная масса вещества Алканы. Циклоалканы
Алканы. Циклоалканы Понятие аналитической химии, её цели и задачи. Химический анализ, его задачи
Понятие аналитической химии, её цели и задачи. Химический анализ, его задачи Химия и производство
Химия и производство Строение вещества
Строение вещества Химическая термодинамика
Химическая термодинамика Взаимодействие молекул (7 класс)
Взаимодействие молекул (7 класс) Соль. Добыча соли
Соль. Добыча соли Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева Транс-жиры
Транс-жиры Карбоновые кислоты
Карбоновые кислоты Физические свойства
Физические свойства углеводы (1)
углеводы (1)