Содержание
- 2. Что читать? Кислотно-основные равновесия в водных растворах. В.А. Собянин, Л.Ф, Крылова, А.И. Боронин, Г.А. Костин. http://www.fen.nsu.ru/posob/gchem/acid_base.pdf
- 3. Вода
- 4. Кислоты и основания Определения: По Аррениусу: Кислота. Вещество, которое при диссоциации дает ионы водорода (Н+) Основание.
- 5. Кислоты и основания Определения: По Брэнстеду: Кислота. Частица донор протонов (Н+) Основание. Акцептор протонов (OН-) Йоханн
- 6. Примеры кислот и оснований по Брэнстэду H2O + H2O ⇄ H3O + + OH- кислота +
- 7. Протонные/апротонные растворители Протонные растворители – одновременно доноры и акцепторы протонов. (Акцепторы за счет не поделённых электронных
- 8. Вода
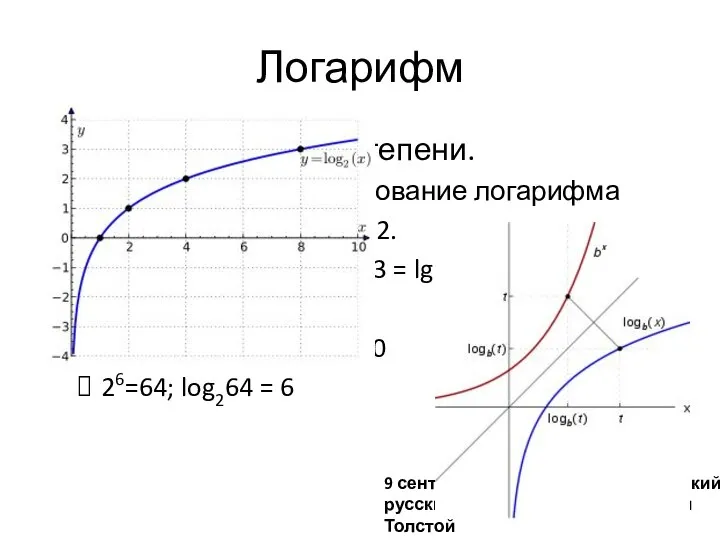
- 9. Логарифм Функция обратная степени. y = x2 ; lnxy = 2; x – основание логарифма Как
- 10. Показатель pH, pK, pβ – показатели водорода (водородный показатель), показатель константы равновесия, показатель константы комплексообразования рН
- 11. pH кислых и основных растворов Протонов больше, чем гидоксид-ионов [H+] > [OH-] – кислый раствор. [H+]
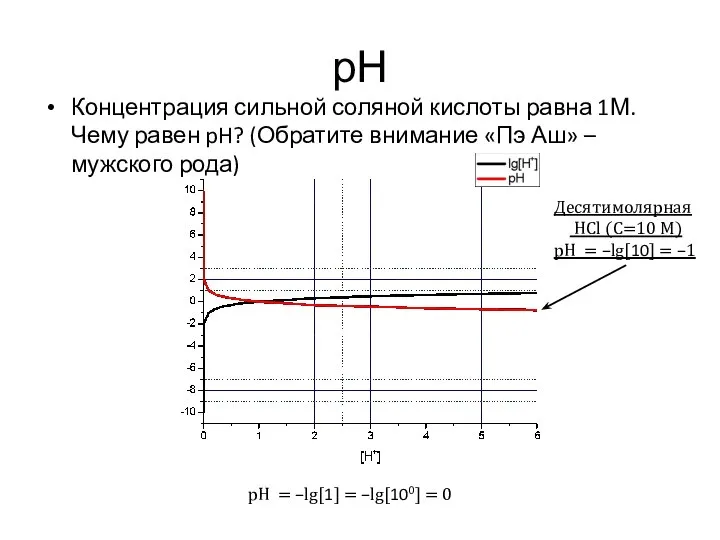
- 12. рН Концентрация сильной соляной кислоты равна 1М. Чему равен pH? (Обратите внимание «Пэ Аш» – мужского
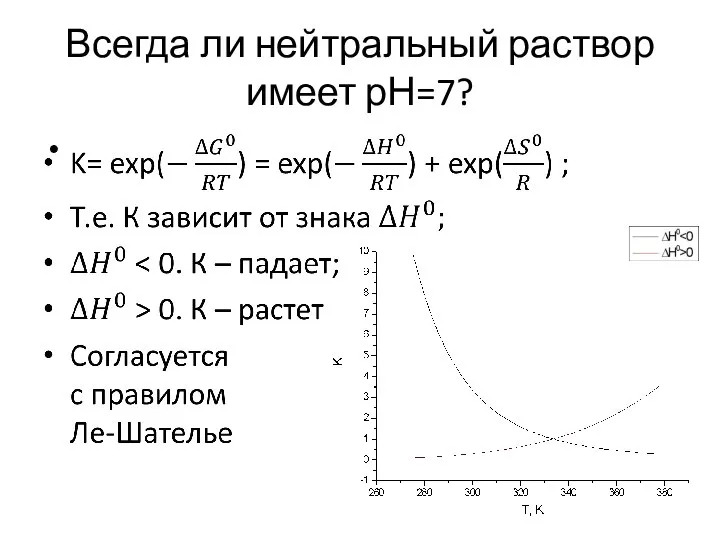
- 13. Всегда ли нейтральный раствор имеет рН=7?
- 14. Всегда ли нейтральный раствор имеет рН=7?
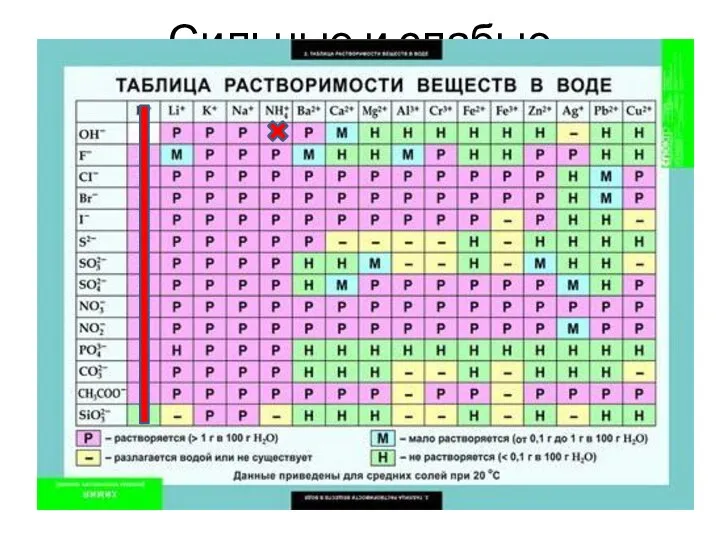
- 15. Сильные и слабые кислоты
- 16. Сильные кислоты C0(HСl) 0 0 0 0+ C0(HСl) 0+ C0(HСl)
- 17. Слабые кислоты
- 18. Слабые кислоты C0(HА) 0 0 C0(HА)-х 0+х 0+х
- 19. Слабые кислоты
- 20. Слабые кислоты C0(HА) 0 0 C0(HА)-х 0+х 0+х
- 21. Слабые кислоты
- 22. Слабые кислоты
- 23. Слабые кислоты
- 24. Давайте разбавим 1 М соляную кислоту
- 25. Самоионизация воды и сильные кислоты
- 26. Примеры растворов и смесей Белильная известь Молоко Нефильтрованное пиво Древесина Кость Кровь Томатный сок Мясной бульон
- 27. Коллоидные растворы Это смеси. Очень тонкие. Растворы промежуточные между истинными растворами и взвесями с размером растворенных
- 28. Истинные растворы Истинные растворы – однофазные, термодинамически устойчивые системы, неограниченно стабильные во времени. Прозрачные системы. Движущими
- 29. Истинные растворы В химической практике наиболее важны растворы, приготовленные на основе жидкого растворителя. Именно жидкие смеси
- 30. Исинные растворы В конце XIX века в науке существовало 2 полярных взгляда на природу растворов. Один
- 31. Способы выражения концентраций
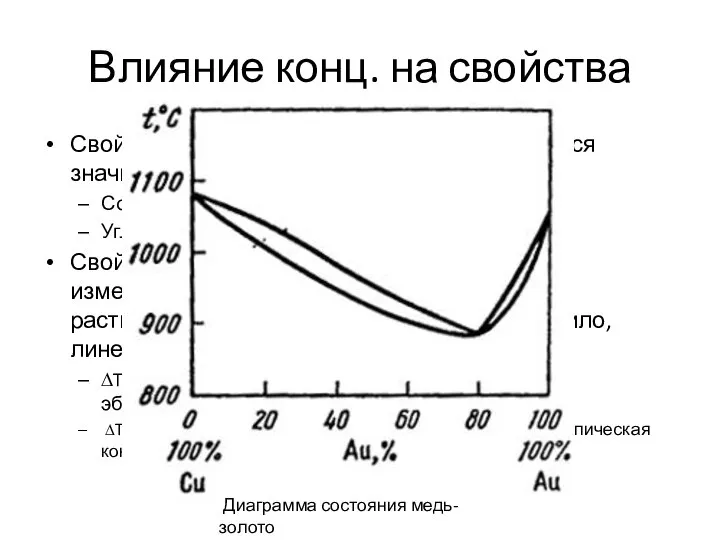
- 32. Влияние конц. на свойства Свойства растворенного вещества изменяются значительно. Соль. Была белой, твердой, тугоплавкой. Углекислый газ.
- 33. Закон Рауля Франсуа Мари Рауль
- 34. Концентрированные и разбавленные растворы.
- 35. Растворы электролитов Растворы веществ проводящих электрический ток. В XIX веке знали, что проводимость свойство заряженных частиц
- 36. Аррениус Отклонения от закона Рауля. Пришлось вводить i – изотонический коэффициент. Сванте Август Аррениус Так было
- 37. Сильные и слабые электролиты Сильные электролиты – хорошо проводят электрический ток. Распадаются на ионы полностью. Растворы
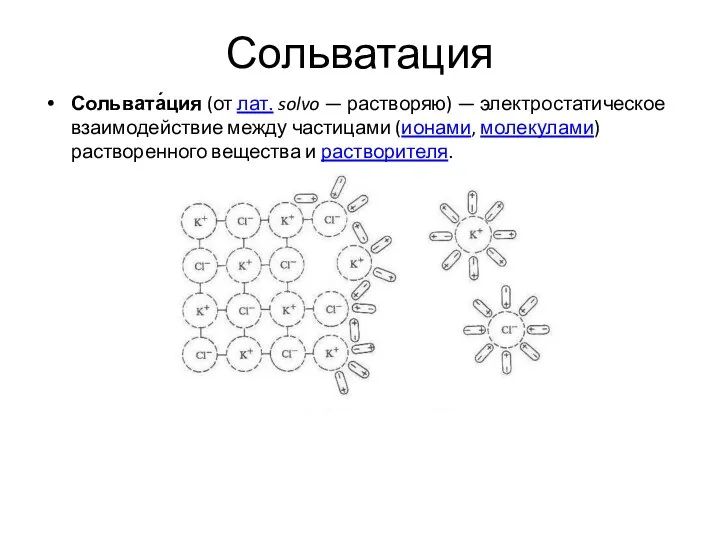
- 38. Сольватация Сольвата́ция (от лат. solvo — растворяю) — электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества
- 39. Сольватация От алхимиков: Подобное в подобном. (лат. similia similibus curentur) Вода и масло Вода, I2 и
- 40. Концентрации сильных электролитов При растворении образуется всегда больше ионов, чем исходного вещества. NaCl → Na+ +
- 41. Уравнение электронейтральности
- 42. Правило фаз
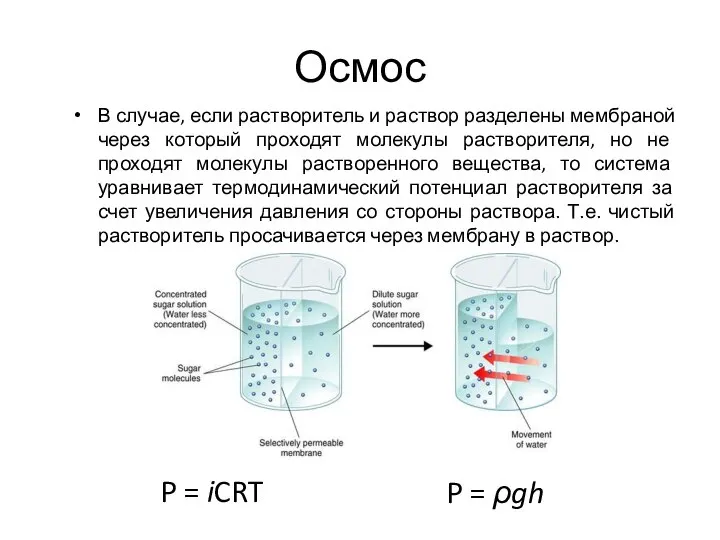
- 43. Осмос В случае, если растворитель и раствор разделены мембраной через который проходят молекулы растворителя, но не
- 44. Осмос Состояние эритроцита в растворах NаСI различной концентрации (в гипотоническом растворе - осмотический гемолиз).
- 46. Скачать презентацию








![pH кислых и основных растворов Протонов больше, чем гидоксид-ионов [H+] > [OH-]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1164649/slide-10.jpg)



























 Химические методы. Качественные реакции, титрование, колорометрический метод
Химические методы. Качественные реакции, титрование, колорометрический метод Презентация на тему Викторина по химии "Что это?"
Презентация на тему Викторина по химии "Что это?" 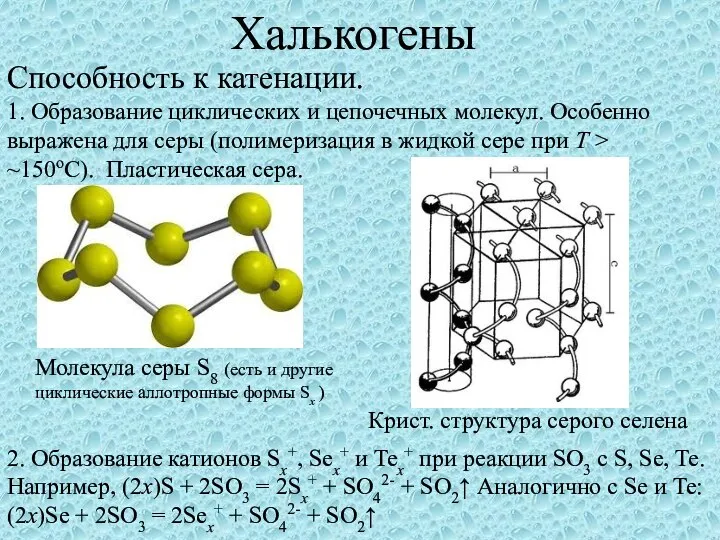 Халькогены. Способность к катенации
Халькогены. Способность к катенации ПОЛОЖЕНИЕ ВОДОРОДА В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
ПОЛОЖЕНИЕ ВОДОРОДА В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования:
Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования: Жиры. Классификация
Жиры. Классификация Высшие жирные кислоты липиды биомембраны. Лекция 3
Высшие жирные кислоты липиды биомембраны. Лекция 3 Переработка нефти
Переработка нефти Химические явления. Закон сохранения массы веществ
Химические явления. Закон сохранения массы веществ Щелочн металлы
Щелочн металлы Сера в таблице Д.И. Менделеева
Сера в таблице Д.И. Менделеева Легкоплавкие сплавы. Изменение свойств сплавов на технологических этапах. Адгезия
Легкоплавкие сплавы. Изменение свойств сплавов на технологических этапах. Адгезия Строение атома
Строение атома Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Альдегиды. Общая формула
Альдегиды. Общая формула Аммиак: состав, строение, свойства, применение
Аммиак: состав, строение, свойства, применение Алифатические и ароматические амины
Алифатические и ароматические амины Уровень С1 в ГИА
Уровень С1 в ГИА Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары
Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары Строение вещества
Строение вещества Кислород и озон
Кислород и озон Салициловая кислота
Салициловая кислота Загадки химии
Загадки химии Презентация на тему Подгруппа кислорода
Презентация на тему Подгруппа кислорода  Химия и нанотехнологии
Химия и нанотехнологии Общая характеристика галогенов. 9 класс
Общая характеристика галогенов. 9 класс Классификация ХГ методов разделения
Классификация ХГ методов разделения Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства