Содержание
- 2. В карстовой пещере
- 3. В царстве Хозяйки Медной горы
- 4. На берегу соляного озера
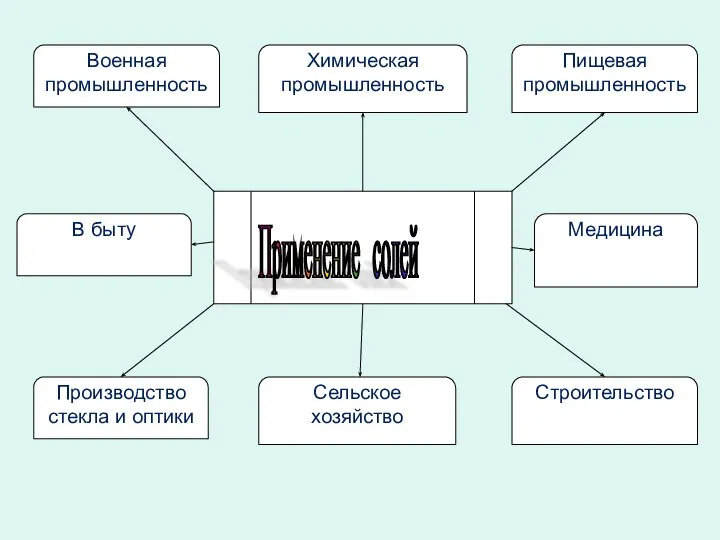
- 5. Применение солей Химическая промышленность Военная промышленность Пищевая промышленность Сельское хозяйство Производство стекла и оптики Строительство В
- 6. Физминутка Вносим в почву мы фосфаты. Не забудем и нитраты. Ну, а осенью, друзья Испеку пирог
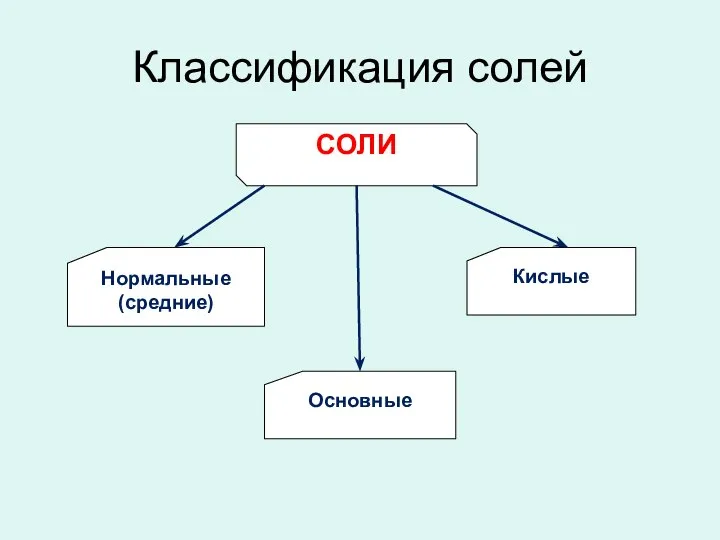
- 7. Классификация солей СОЛИ Нормальные (средние) Кислые Основные
- 8. Лабораторный опыт
- 9. Рассмотрите образцы солей. Что вы можете сказать о цвете? В каждую пробирку добавьте немного воды и
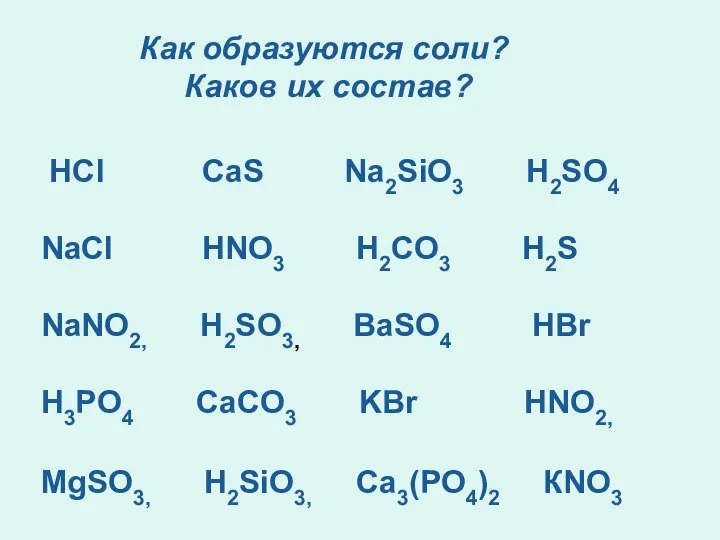
- 10. Как образуются соли? Каков их состав? HCl CaS Na2SiO3 H2SO4 NaCl HNO3 H2CO3 H2S NaNO2, H2SO3,
- 11. Типичные реакции солей 1. соль + кислота = др.соль.+ др. кислота 2. соль + щелочь =
- 12. Выводы 1. Познакомились с солями. 2. Соли - нормальные, кислые, основные. 3. Твердые вещества, различного цвета
- 14. Скачать презентацию








 Общие сведения о питании и приготовлении пищи
Общие сведения о питании и приготовлении пищи Способы получения металлов. Сплавы металлов
Способы получения металлов. Сплавы металлов Ароматические углеводороды
Ароматические углеводороды Инертные газы и перспективы их применения
Инертные газы и перспективы их применения Солеобразующие оксиды
Солеобразующие оксиды Химия в игре. Проектная работа
Химия в игре. Проектная работа Применение арт-технологии на уроках химии Обобщение опыта педагогической деятельности МОУ СОШ № 14 город Мончегорск Мурманск
Применение арт-технологии на уроках химии Обобщение опыта педагогической деятельности МОУ СОШ № 14 город Мончегорск Мурманск Предельные углеводороды насыщенные, парафины, алканы
Предельные углеводороды насыщенные, парафины, алканы Оксиды и гидрооксиды
Оксиды и гидрооксиды Марказит (лучистый колчедан, капельное серебро)
Марказит (лучистый колчедан, капельное серебро) Уравнение состояния идеального газа. Газовые законы. Изопроцессы
Уравнение состояния идеального газа. Газовые законы. Изопроцессы Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Презентация по Химии "Химические свойства галогенов"
Презентация по Химии "Химические свойства галогенов"  Электромагнитное облучение. Радиоактивное загрязнение
Электромагнитное облучение. Радиоактивное загрязнение Неорганические вещества клетки
Неорганические вещества клетки Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Классификация химических реакций по различным основаниям
Классификация химических реакций по различным основаниям Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии
Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии Електролітична дисоціація
Електролітична дисоціація Состав атомного ядра
Состав атомного ядра Бензол (Арены )
Бензол (Арены ) Презентация на тему Химия в криминалистике
Презентация на тему Химия в криминалистике  Алкены
Алкены Кислород и водород. Сходства и различия
Кислород и водород. Сходства и различия Диэлектрики
Диэлектрики Простые вещества - неметаллы
Простые вещества - неметаллы Спирты. Методы получения
Спирты. Методы получения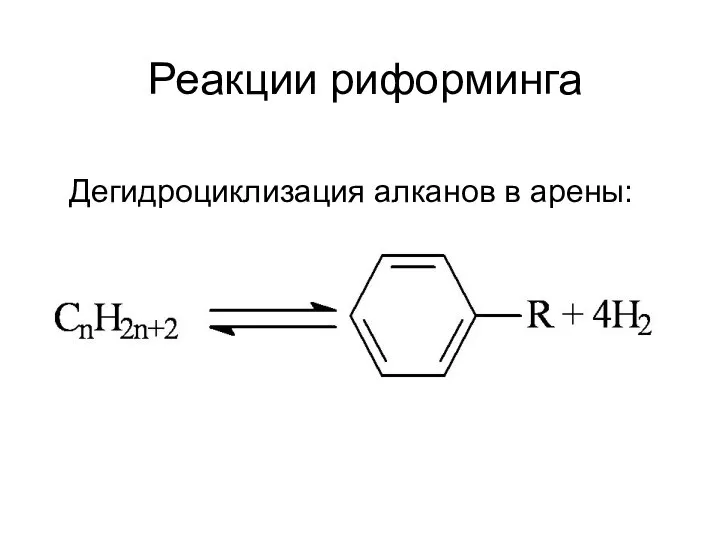 Реакции риформинга
Реакции риформинга