Содержание
- 2. Цель Установить, как катализаторы влияют на протекание и продукты реакции 2
- 3. Задачи 1.Рассмотреть, что такое катализатор и его влияние на реакцию. 2.Изучить механизм процесса Фишера-Тропша. 3.Предложить каталитические
- 4. Влияние катализатора на протекание реакций Катализатор - вещество, которое повышает скорость химической реакции, но само в
- 6. Основные типы катализаторов в кислотно-основных процессах Кислота по Бренстеду (HCl, H2SO4 , ROH, ) – вещество,
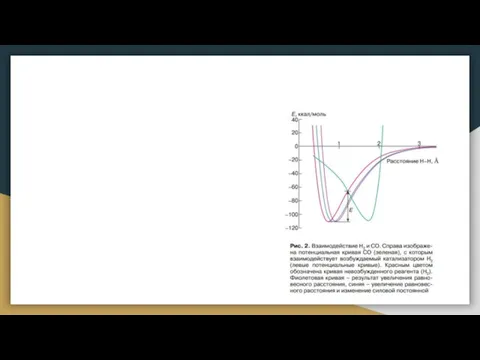
- 7. Реакция Фишера-Тропша 5 [1]
- 8. Механизм реакции Фишера-Тропша 1) адсорбция реагентов на поверхности катализатора, 2) образование активных частиц, 3) рост углеводородной
- 9. Адсорбция реагентов на поверхности катализатора Н2,газ → Н2, адс Н2,газ → 2Надс селективность определяется адсорбцией СО
- 10. Диссоциация СО на разных металлах происходит при разных температурах. Так, на Fe, Mn, Cr, Mo, W
- 11. Общий вид сорбции Вероятность протекания реакций (3) и (4) и соотношение их скоростей определяются природой металла,
- 12. Образование активных частиц На каталитической поверхности содержится целый ряд активных частиц (С, СО, СО2, Н2О, О,
- 13. Cn,адс + С1,адс → Сn+1,адс [5] Рост цепи 10 [2]
- 14. Обрыв цепи Бексислородных соединений Кислородосодержащих соединений 11 [2]
- 15. Десорбция продуктов В каталитической системе десорбция вновь образующихся соединений затруднена из-за диффузии через слой ранее образовавшихся
- 16. Реакция гидрирования алкинов Механизм гидрирования алкинов 13 Вид частиц, сорбированных на поверхности катализатора [3]
- 19. Реакция межмолекулярной дегидратации спиртов [3] 14
- 20. Реакция дегидратации спиртов в кислой среде 15 [4]
- 21. Заключение Таким образом, нами был рассмотрен процесс Фишера-Тропша, а также предложены примеры реакций, в которых показано
- 22. Источники информации А. А. Кубасов «Почему катализатор ускоряет химические реакции» 2001г А. Л. Лапидус, А. Ю.
- 23. Спасибо за внимание
- 25. Скачать презентацию




![Реакция Фишера-Тропша 5 [1]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/858217/slide-6.jpg)





![Cn,адс + С1,адс → Сn+1,адс [5] Рост цепи 10 [2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/858217/slide-12.jpg)
![Обрыв цепи Бексислородных соединений Кислородосодержащих соединений 11 [2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/858217/slide-13.jpg)

![Реакция гидрирования алкинов Механизм гидрирования алкинов 13 Вид частиц, сорбированных на поверхности катализатора [3]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/858217/slide-15.jpg)
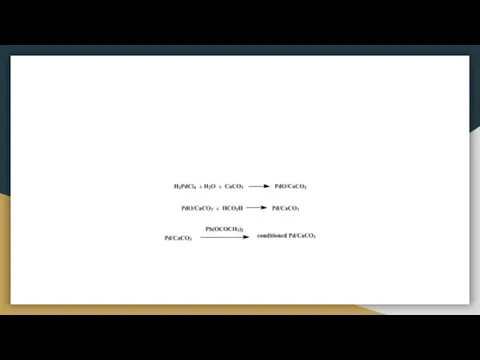

![Реакция межмолекулярной дегидратации спиртов [3] 14](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/858217/slide-18.jpg)
![Реакция дегидратации спиртов в кислой среде 15 [4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/858217/slide-19.jpg)



 Химическая реакция
Химическая реакция Соли. 8 класс
Соли. 8 класс Алкены
Алкены Презентация на тему Нанотехнологии в химии
Презентация на тему Нанотехнологии в химии  Природные источники углеводородов. Нефть. Нахождение в природе,состав и физические свойства
Природные источники углеводородов. Нефть. Нахождение в природе,состав и физические свойства Уравнение состояния идеального газа. Газовые законы. Изопроцессы
Уравнение состояния идеального газа. Газовые законы. Изопроцессы Основания и их свойства
Основания и их свойства Электролиз
Электролиз ОВР. Метод электронного баланса
ОВР. Метод электронного баланса Неидеальные растворы
Неидеальные растворы Введение. Тренажер
Введение. Тренажер Процессы растворения твёрдых веществ
Процессы растворения твёрдых веществ Нуклеин қышқылдары
Нуклеин қышқылдары Соли
Соли Винная кислота
Винная кислота Технология производства и свойства химических волокон и тканей из них
Технология производства и свойства химических волокон и тканей из них Альдегиды, гомология, изомерия, номенклатура
Альдегиды, гомология, изомерия, номенклатура Презентация по Химии "Законы газового состояния вещества"
Презентация по Химии "Законы газового состояния вещества"  Дисахариды и полисахариды
Дисахариды и полисахариды Гальванические элементы
Гальванические элементы Химические свойства металлов
Химические свойства металлов Пищевые добавки: вред и польза
Пищевые добавки: вред и польза 9. Потомки светоносного элемента
9. Потомки светоносного элемента Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу
Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу Индолы. Cтроение индола
Индолы. Cтроение индола Презентация на тему Химический алфавит
Презентация на тему Химический алфавит  Известняк. Разновидности известняка. Области применения
Известняк. Разновидности известняка. Области применения Сложные эфиры. Содержание. Определение
Сложные эфиры. Содержание. Определение