Содержание
- 3. P⁰ + 3e → P‾³ Na⁺ + 1e → Na⁰ S⁺6 + 2e → S⁺4 S+4
- 4. Ba⁰ - 2e → Ba⁺² S‾² - 2e → S⁰ Fe⁺² - 1e→ Fe⁺³ N⁺3 -
- 7. Правила уравнивания окислительно-восстановительных реакций (обязательно списать и выучить) 1. Определим степени окисления каждого элемента . 2.
- 8. Na2 SO3 + KMnO4 + H2SO4 = K2SO4 + MnSO4 + Na2 SO4 + H2O Восстановление:
- 9. Na + O₂ → Na₂O Al + Cl₂ → AlCl₃ Fe₂O₃ + H₂ →Fe + H₂O
- 10. Na⁰ - 1 e → Na⁺| 4 O⁰₂ + 2 ∙ 2e → 2O⁻² | 1
- 14. Скачать презентацию
Слайд 3P⁰ + 3e → P‾³ Na⁺ + 1e → Na⁰
S⁺6 + 2e
P⁰ + 3e → P‾³ Na⁺ + 1e → Na⁰
S⁺6 + 2e

Cl⁰ + 1e → Cl‾ Cl⁺⁷ + 8e→ Cl-¹
Процессы восстановления ( +е )
степень окисления У М Е Н Ь Ш А Е Т С Я
Слайд 4 Ba⁰ - 2e → Ba⁺² S‾² - 2e → S⁰
Fe⁺² -
Ba⁰ - 2e → Ba⁺² S‾² - 2e → S⁰
Fe⁺² -

S⁺4 - 2e→ S⁺6 Na⁰ - 1e → Na⁺
Процессы окисления ( - е )
степень окисления У В Е Л И Ч И В А Е Т С Я
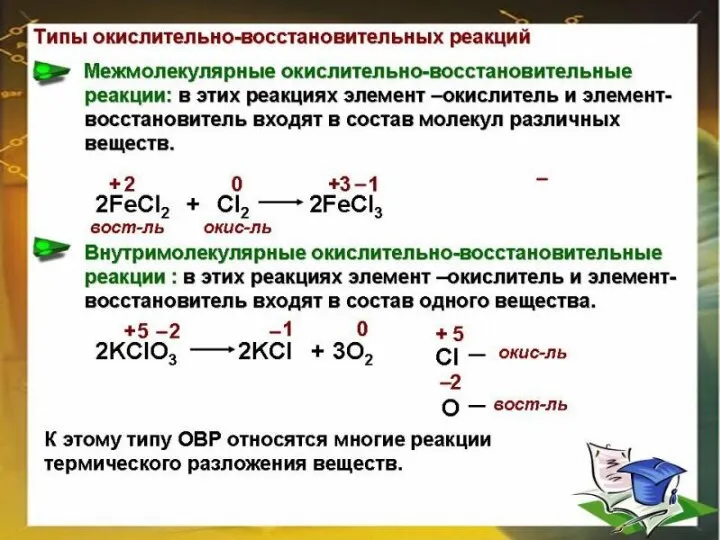
Слайд 7Правила уравнивания окислительно-восстановительных реакций (обязательно списать и выучить)
1. Определим степени окисления каждого
Правила уравнивания окислительно-восстановительных реакций (обязательно списать и выучить)
1. Определим степени окисления каждого

2. Подчеркнем символы элементов, изменяющие степени
окисления.
3. Составим электронный баланс
( уравнения процессов окисления – восстановления).
Находим множители для уравнений процессов
окисления-восстановления.
4. Найденные множители запишем перед формулами продуктов
окислителя и восстановителя, то есть в правую часть уравнения
реакции.
5. Расставим коэффициенты в уравнении реакции
( в последнюю очередь перед кислородом и водородом).
6. Проверяем себя по кислороду
Слайд 8Na2 SO3 + KMnO4 + H2SO4 = K2SO4 + MnSO4 + Na2
Na2 SO3 + KMnO4 + H2SO4 = K2SO4 + MnSO4 + Na2

Восстановление: Mn+7 + 5e → Mn+2 | 2
Окисление: S+4 - 2e → S+6 | 5
Mn - окислитель S – восстановитель
5Na2 SO3 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 +5 Na2 SO4+ 3H2O
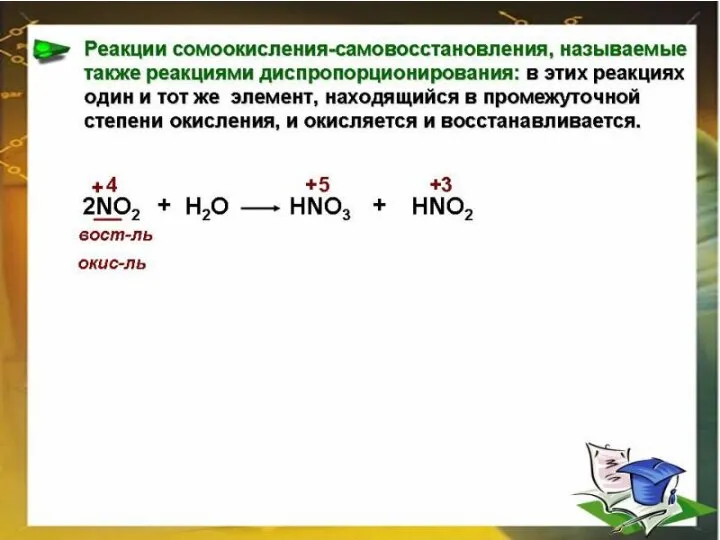
H₂S‾² + O₂⁰ = H₂O‾² + S⁺⁴O₂
Окисление: S‾² - 6e → S⁺⁴ |4 | 2
Восстановление: O₂⁰ + 4e → 2O‾² | 6| 3
Окислитель : O₂⁰ Восстановитель: S‾²
2H₂S‾² + 3 O₂⁰ = 2 H₂O‾² + 2 S⁺⁴O₂
ПРИМЕРЫ
Слайд 9Na + O₂ → Na₂O Al + Cl₂ → AlCl₃
Fe₂O₃ + H₂
Na + O₂ → Na₂O Al + Cl₂ → AlCl₃
Fe₂O₃ + H₂
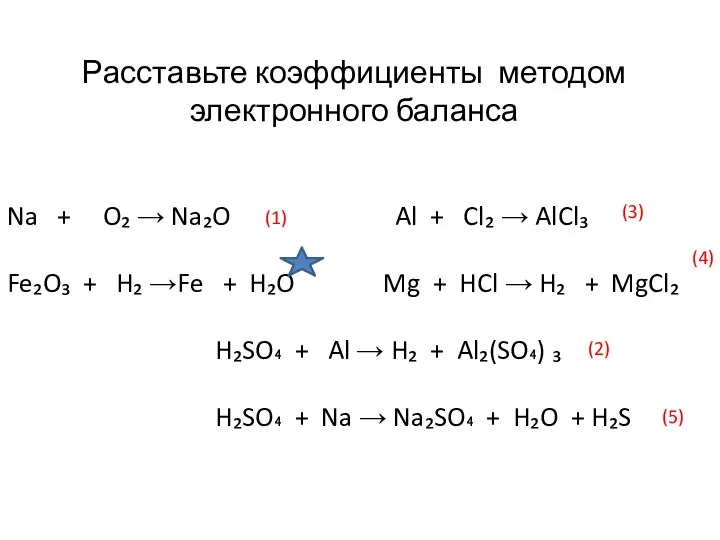
H₂SO₄ + Al → H₂ + Al₂(SO₄) ₃
H₂SO₄ + Na → Na₂SO₄ + H₂O + H₂S
Расставьте коэффициенты методом
электронного баланса
(1)
(2)
(3)
(4)
(5)
Слайд 10Na⁰ - 1 e → Na⁺| 4
O⁰₂ + 2 ∙ 2e →
Na⁰ - 1 e → Na⁺| 4
O⁰₂ + 2 ∙ 2e →
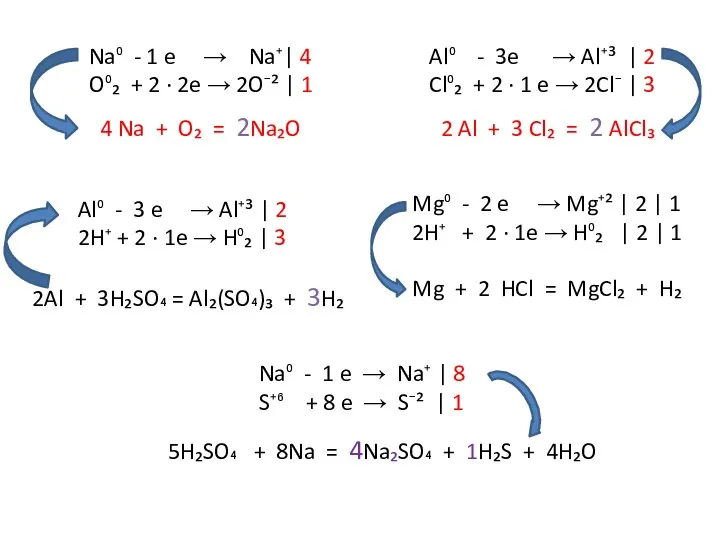
4 Na + O₂ = 2Na₂O
Al⁰ - 3e → Al⁺³ | 2
Cl⁰₂ + 2 ∙ 1 e → 2Cl⁻ | 3
2 Al + 3 Cl₂ = 2 AlCl₃
Mg⁰ - 2 e → Mg⁺² | 2 | 1
2H⁺ + 2 ∙ 1e → H⁰₂ | 2 | 1
Mg + 2 HCl = MgCl₂ + H₂
Al⁰ - 3 e → Al⁺³ | 2
2H⁺ + 2 ∙ 1e → H⁰₂ | 3
2Al + 3H₂SO₄ = Al₂(SO₄)₃ + 3H₂
Na⁰ - 1 e → Na⁺ | 8
S⁺⁶ + 8 e → S⁻² | 1
5H₂SO₄ + 8Na = 4Na₂SO₄ + 1H₂S + 4H₂O



 Алканы
Алканы Презентация на тему Алмазы Индии
Презентация на тему Алмазы Индии  Формирование УУД на уроках химии
Формирование УУД на уроках химии 564481
564481 Входное тестирование по химии
Входное тестирование по химии Система маркировки пластика
Система маркировки пластика Водород. История открытия
Водород. История открытия Степень окисления
Степень окисления Классификация реакций. Таблица
Классификация реакций. Таблица Термодинамика. Основные понятия и законы. Особенности термодинамики живых систем
Термодинамика. Основные понятия и законы. Особенности термодинамики живых систем Искусственные и синтетические ткани
Искусственные и синтетические ткани Кристаллы и минералы
Кристаллы и минералы Составитель: Денисова В.Г.
Составитель: Денисова В.Г. Подготовка к контрольной работе
Подготовка к контрольной работе Получение и применение алканов (10 класс)
Получение и применение алканов (10 класс) Дисперсные системы. Тест
Дисперсные системы. Тест Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"
Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"  Сплавы. 9 класс
Сплавы. 9 класс Prezentatsia_lektsia_Reaktora_1_Klassifikatsia
Prezentatsia_lektsia_Reaktora_1_Klassifikatsia Тест 1 задание
Тест 1 задание Алгоритм названия органического соединения
Алгоритм названия органического соединения Презентация на тему Типы химических реакций (8 класс)
Презентация на тему Типы химических реакций (8 класс)  Стехиометрические законы химии
Стехиометрические законы химии Жиры – биологически важные органические соединения
Жиры – биологически важные органические соединения Галогены и их соединения
Галогены и их соединения Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева Знаки химических элементов. 8 класс
Знаки химических элементов. 8 класс Первоначальные химические понятия
Первоначальные химические понятия