Содержание
- 2. Химия – это наука о веществах, их свойствах и превращениях Физическое тело вещество Химический элемент -
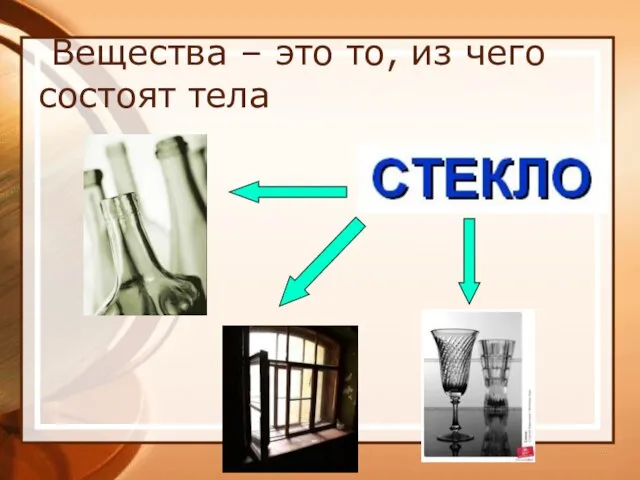
- 4. Вещества – это то, из чего состоят тела
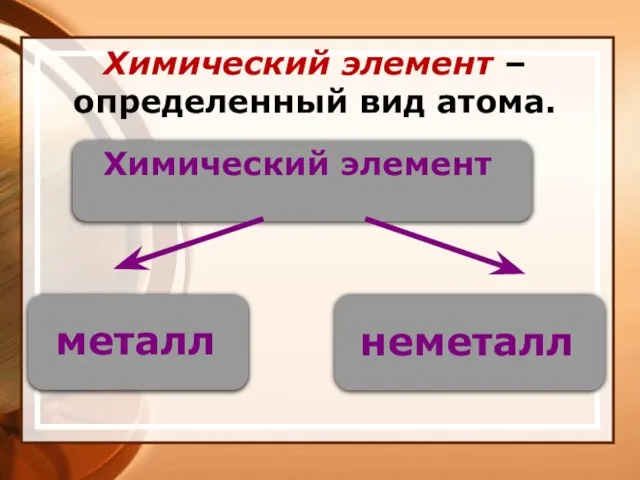
- 5. Химический элемент – определенный вид атома.
- 6. План характеристики элемента: 1. Символ и название. 2. Положение в ПСХЭ. 3. Строение атома. 4. Электронная
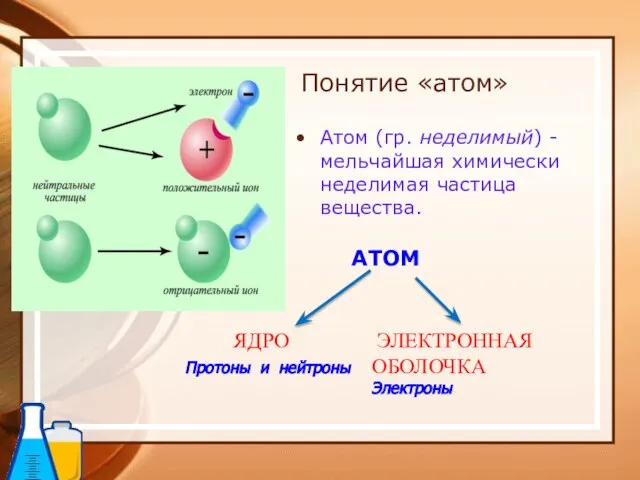
- 7. Ион - Заряженная частица вещества NA+, Cl- , SO4 2-, Al3+
- 8. это вещества, состоящие из атомов одного химического элемента это вещества, состоящие из атомов двух или нескольких
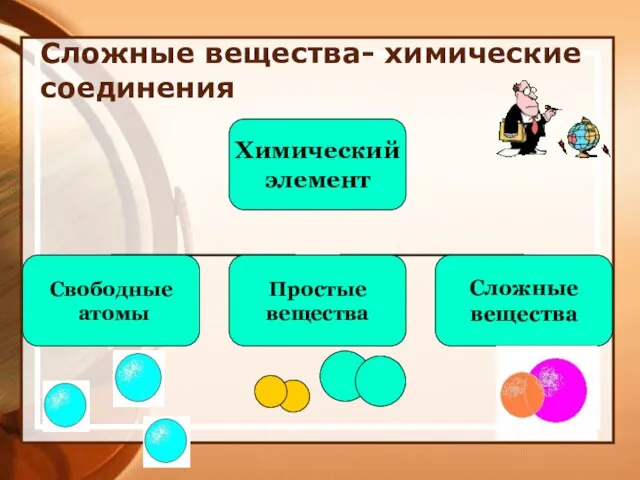
- 9. Сложные вещества- химические соединения
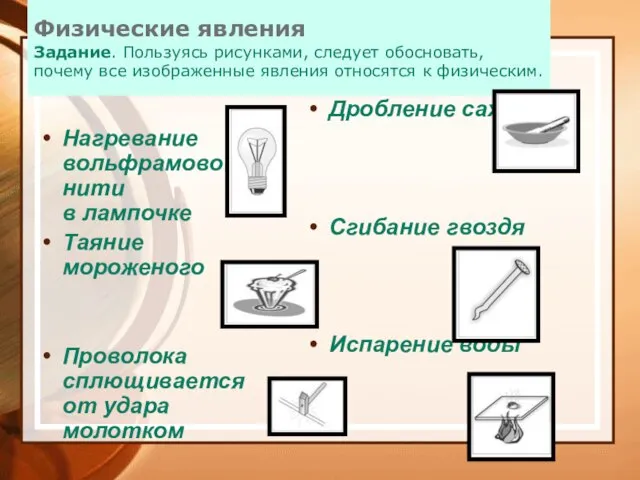
- 10. Физические явления Задание. Пользуясь рисунками, следует обосновать, почему все изображенные явления относятся к физическим. Нагревание вольфрамовой
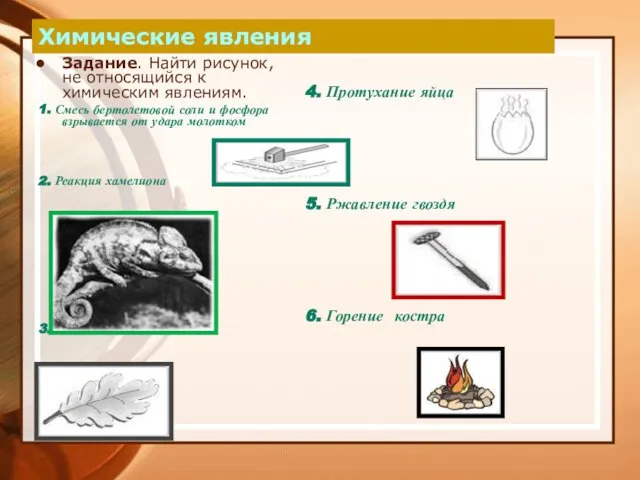
- 11. Химические явления Задание. Найти рисунок, не относящийся к химическим явлениям. 1. Смесь бертолетовой соли и фосфора
- 12. Признаки химической реакции Изменение окраски. Выделение или поглощение теплоты. Появление запаха. Образования осадка. Выделение газа.
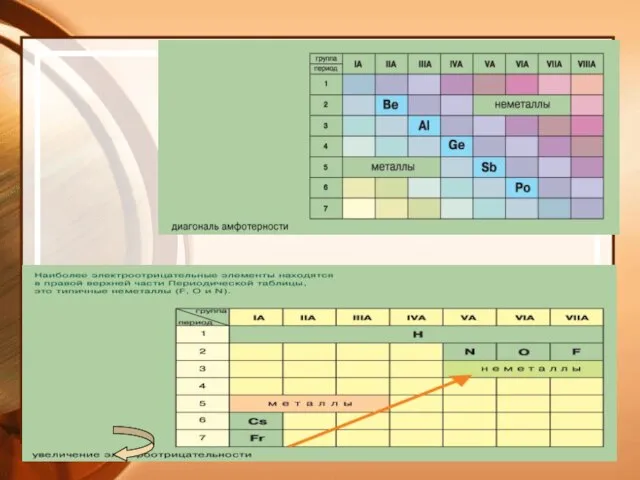
- 13. ПЕРИОДИЧНОСТЬ СВОЙСТВ в ПЕРИОДАХ: В пределах одного периода слева направо металлические свойства ослабевают; А неметаллические возрастают.
- 14. Под ВАЛЕНТНОСТЬ (сила) понимают свойства атомов образовывать химические связи с другими атомами, а также число одинарных
- 15. Химические формулы Химическая формула – это условная запись состава вещества посредством химических знаков и индексов.
- 16. Химическая формула.
- 17. Закон постоянства состава вещества или закон Пруста. каждое химически чистое вещество с молекулярным строением независимо от
- 18. Индекс показывает количество атомов данного элемента в молекуле. Итак, состав веществ выражается химическими формулами с целочисленными
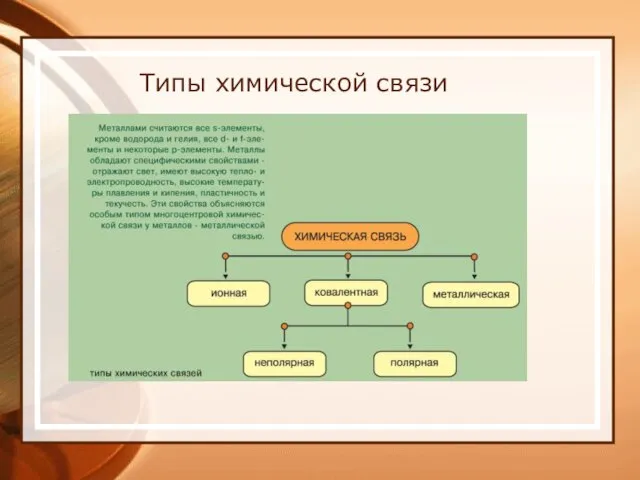
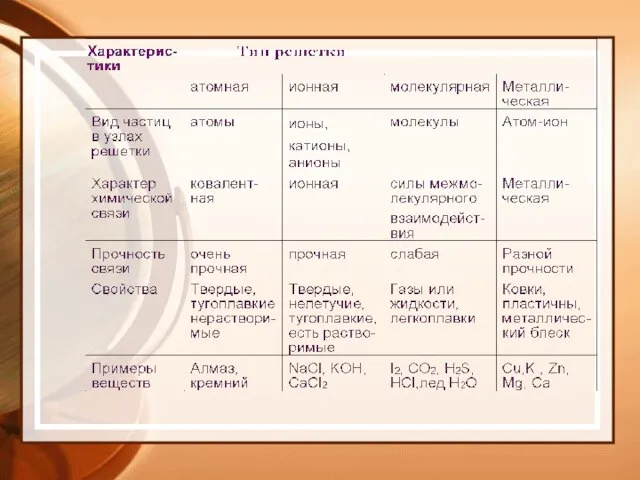
- 19. Типы химической связи
- 21. Электроотрицательность - способность атомов оттягивать на себя электроны. Ряд ЭО: Si H P C S Br
- 23. Металлы Na K Ca Ba Cu Ag Au Zn Pb Hg Al Mg Mn Fe натрий
- 24. Неметаллы S Cl Br C Si J N P O F H cера углерод водород кремний
- 25. Au 79 196, 97 число, показывающее во сколько раз масса данного атома больше массы атома водорода
- 26. Массовые доли элементов. ФОРМУЛА: Ar (эл.)• n W(эл.) Mr (в-ва) Единицы измерения [доли] или [%], в
- 27. Понятие «атом» Атом (гр. неделимый) - мельчайшая химически неделимая частица вещества. АТОМ
- 28. ОСНОВНЫЕ ПОЛОЖЕНИЯ ПЛАНЕТАРНОЙ МОДЕЛИ: Атом – это микрочастица, которая имеет форму шара. Атом – это сложная
- 29. Как измерить вещество? Необходимо точно знать число частиц вещества, т.е. его количество Единица количества вещества –
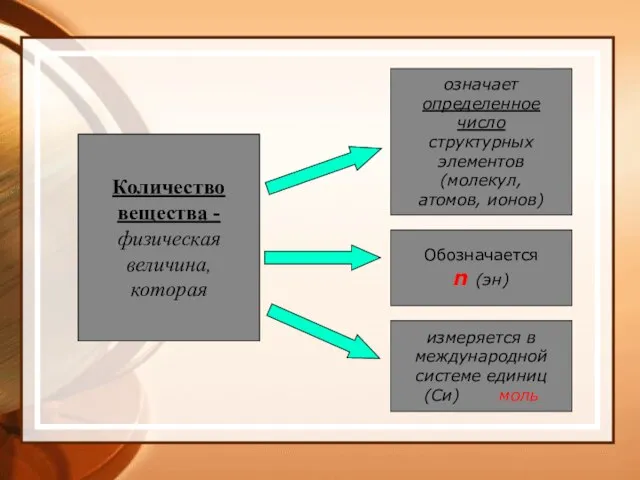
- 30. Количество вещества - физическая величина, которая означает определенное число структурных элементов (молекул, атомов, ионов) Обозначается n
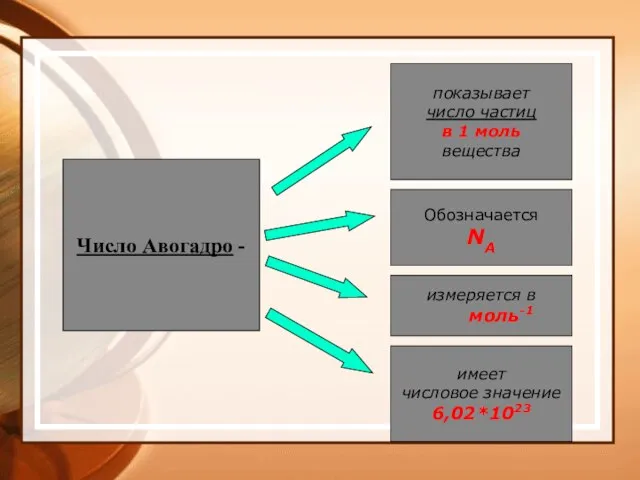
- 31. Число Авогадро - показывает число частиц в 1 моль вещества Обозначается NA измеряется в моль-1 имеет
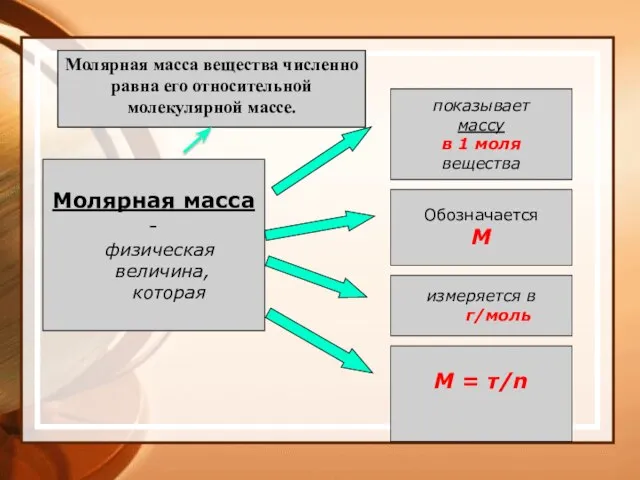
- 32. Молярная масса - физическая величина, которая показывает массу в 1 моля вещества Обозначается М измеряется в
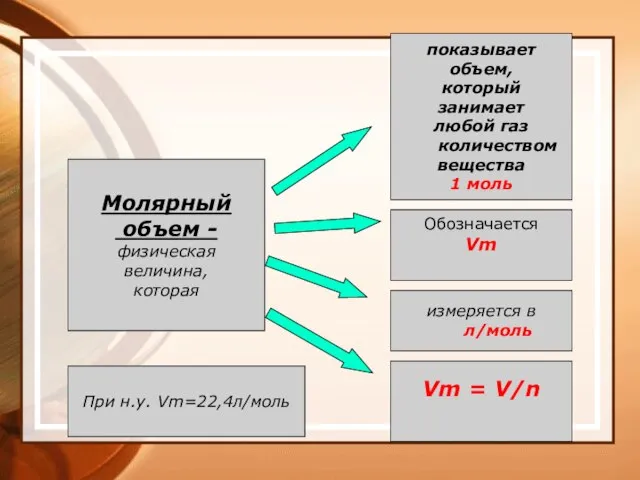
- 33. Для расчёта количества n= m / М n=V/Vm n =N / Na
- 34. Но если число частиц известно? В 1 моле содержится 6 ● 10 23 частиц Эта величина
- 35. Амедео Авогадро высказал предположение в 1811 году, что В равных объемах различных газов при одинаковых условиях
- 36. Молярный объем газа Vm — величина, определяемая отношением объема данной порции газа V к химическому количеству
- 37. Молярный объем - физическая величина, которая показывает объем, который занимает любой газ количеством вещества 1 моль
- 38. Производные формулы Иванова Г.А. [email protected] m= n ● М V=n ● Vm N =n ● Na
- 39. Отношение массы растворимого вещества к общей массе раствора называют массовой долей растворенного вещества. Массовую долю обозначают
- 41. Скачать презентацию

























 Металлургия
Металлургия Настольная образовательная игра по химии. Мастер - класс
Настольная образовательная игра по химии. Мастер - класс Явления, происходящие с веществами
Явления, происходящие с веществами Индикаторная бумага
Индикаторная бумага Презентация на тему Виды химической связи
Презентация на тему Виды химической связи  Молярный объем газов
Молярный объем газов Подготовка выпускников к ГИА по химии: опыт, проблемы, перспективы
Подготовка выпускников к ГИА по химии: опыт, проблемы, перспективы Закон сохранения массы. 11 класс
Закон сохранения массы. 11 класс Презентация на тему Алканолы
Презентация на тему Алканолы  Альдегиды, строение и свойства
Альдегиды, строение и свойства Элемент Фосфор
Элемент Фосфор Кислородсодержащие соединения азота. Оксиды азота
Кислородсодержащие соединения азота. Оксиды азота Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Нитраты
Нитраты Презентация на тему Ионные уравнения
Презентация на тему Ионные уравнения  Конкурс проектных работ Химический элемент … – и это все о нем
Конкурс проектных работ Химический элемент … – и это все о нем Вода И её значение
Вода И её значение Химическая связь и ее типы
Химическая связь и ее типы Алкины
Алкины Простые вещества металлы
Простые вещества металлы Относительная молекулярная масса вещества
Относительная молекулярная масса вещества Синтетические волокна
Синтетические волокна Презентация на тему Многоатомные спирты
Презентация на тему Многоатомные спирты  Пропитка рубинов и сапфиров
Пропитка рубинов и сапфиров Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Презентация на тему Неорганическая химия: подготовка к ГИА
Презентация на тему Неорганическая химия: подготовка к ГИА  Электролиз расплавов и растворов электролитов
Электролиз расплавов и растворов электролитов Характеристика элемента по Периодической системе Д.И. Менделеева
Характеристика элемента по Периодической системе Д.И. Менделеева