Содержание
- 2. 1. Понятие о химической связи. Химическая связь - это связь между элементами в соединении за счет
- 3. 2. Основные положения теории химической связи: 1) В образовании связи участвуют наружные неспаренные электроны с противоположными
- 4. Ковалентная связь. Химическая связь между атомами, осуществляемая общими электронными парами, называется ковалентной. Характерна для неметаллов Н2:
- 5. Электроотрицательность (ЭО) ЭО в периоде возрастает в группе Свойство атомов смещать к себе общие электронные пары,
- 6. Виды ковалентной связи полярная неполярная (разные неметаллы) (одинаковые НЕ) HCl, NH3, CH4 Cl2, N2, O2 Образуются
- 7. Урок № 2 З – 1. В каких из приведенных ниже веществ химическая связь полярна, а
- 8. Ионная связь Рассмотрим образование соединений сильно отличающихся по ЭО. Это соединения МЕ и НЕМ. Пример: NaCl
- 9. Работа с учебником. СТР. 24: * ПОНЯТИЕ ИОННОЙ СВЯЗИ * ИОННЫЕ СОЕДИНЕНИЯ 2) ? В ТЕКСТЕ
- 10. Закрепление. Определить вид химической связи: А) NH3, Б) CH4, В) I2, Г) KF, Д) CO2, Е)
- 11. Домашнее задание. 1) § 3 стр.24 – 28 2) Повторить § 1, 2 3) ? ∆
- 12. - Возникновение общих электронных пар приводит к образованию ковалентной химической связи между атомами . - Атомы
- 13. 23.09.10г Урок № 7 Степень окисления атомов в соединениях. 1. Работа с учебником § 4 СТР.
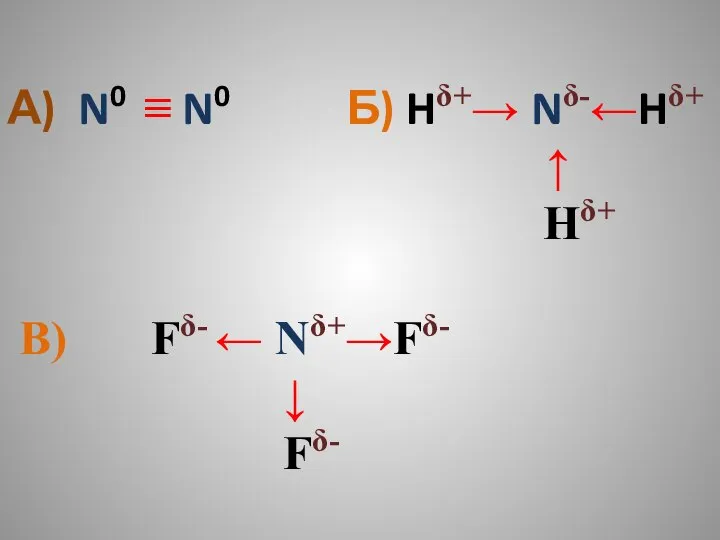
- 14. а)N Ξ N б) H — N — H в) F — N — F |
- 15. А) N0 ≡ N0 Б) Hδ+→ Nδ-←Hδ+ ↑ Hδ+ В) Fδ- ← Nδ+→Fδ- ↓ Fδ-
- 16. ДЛЯ ЧЕГО ВВЕДЕНО ПОНЯТИЕ СТЕПЕНИ ОКИСЛЕНИЯ? ЧТО ТАКОЕ СТЕПЕНЬ ОКИСЛЕНИЯ? РАБОТА С УЧЕБНИКОМ: СТР. 30 2абзац
- 17. Работа с алгоритмом. *Как определяют степень окисления? *что для этого необходимо знать? Тренировочное задание: ? В
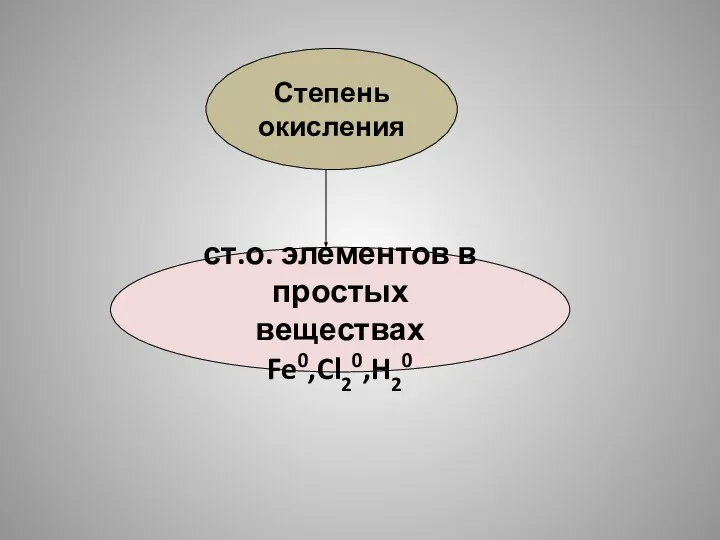
- 18. Степень окисления ст.о. элементов в простых веществах Fe0,Cl20,H20
- 19. Определите степени окисления элементов Al2O3 Ca3N2 K2Se P2O5 Cl2O7 As2O3 Al2+3O3-2 Ca3+2N2-3 K2+1Se-2 P2+5O5-2 Cl2+7O7-2 As2+3O3-2
- 20. Составление химических формул по степени окисления АЛГОРИТМ: Записать химические знаки элементов Al S Определить ст.о. элементов
- 21. Определение степени окисления в формуле из трех атомов химических элементов 3. Работа с учебником стр. 33-34
- 23. Скачать презентацию


















 Современные способы защиты ОТТ
Современные способы защиты ОТТ Хімічний експеримент
Хімічний експеримент Неметаллы и их соединения
Неметаллы и их соединения Минералы и горные породы
Минералы и горные породы Номенклатура алканов РВЛ
Номенклатура алканов РВЛ Алканы
Алканы Контрольная работа №1
Контрольная работа №1 Никель и его соединения
Никель и его соединения Презентация на тему Полезная химия во фруктах и овощах
Презентация на тему Полезная химия во фруктах и овощах  Презентация на тему Щелочные металлы
Презентация на тему Щелочные металлы  Основные положения качественного анализа. Лекция №7
Основные положения качественного анализа. Лекция №7 Электролитическая диссоциация
Электролитическая диссоциация Понятие электродного потенциала и методы его измерения
Понятие электродного потенциала и методы его измерения Химическое равновесие. Задачи
Химическое равновесие. Задачи Фотодиссоциация кислорода
Фотодиссоциация кислорода Презентация на тему ОВР в органической химии
Презентация на тему ОВР в органической химии  Основные классы неорганических соединений
Основные классы неорганических соединений Валентность. Нахождение химической формулы вещества по валентности
Валентность. Нахождение химической формулы вещества по валентности Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс)
Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс) Концепция химической связи
Концепция химической связи Производство стекла
Производство стекла Kaloshina_Irina
Kaloshina_Irina Композитные материалы
Композитные материалы Кристаллы. Виды
Кристаллы. Виды Алюминий и сплавы алюминия
Алюминий и сплавы алюминия Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Анализ свойств карбамидоформальдегидных смол
Анализ свойств карбамидоформальдегидных смол Алкадиены
Алкадиены