Слайд 2Антибиотики
вещества природного происхождения, обладающие выраженной биологической активностью. Они могут быть получены

из микробов, растительных и животных тканей, синтетическим путем
З.В.Ермольева
Слайд 3Классификация антибиотиков
По степени воздействия
По происхождению
По механизму действия
По химическому строению

Слайд 4По степени воздействия на бактериальную клетку
Бактериостатические (группа тетрациклина, хлорамфеникол)
Бактерицидные (β-лактамы, аминогликозиды)

Слайд 5По происхождению
Антибиотики, полученные из грибов, например рода Penicillium (пенициллин), рода Cephalosporium (цефалоспорины)
Антибиотики,

полученные из актиномицетов; группа включает около 80% всех антибиотиков. Среди актиномицетов основное значение имеют представители рода Streptomyces, являющиеся продуцентами стрептомицина, эритромицина, левомицетина.
Антибиотики, продуцентами которых являются собственно бактерии. Чаще всего с этой целью используют представителей рода Bacillus и Pseudomonas. Примерами антибиотиков данной являются полимиксины, бацитрацины, грамицидин
Антибиотики животного происхождения; из рыбьего жира получают эктерицид, из молок рыб – экмолин, из эритроцитов – эритрин
Антибиотики растительного происхождения. К ним можно отнести фитонциды, которые выделяют лук, чеснок, сосна, ель, сирень, другие растения. В чистом виде они не получены, так как являются чрезвычайно нестойкими соединениями
Полусинтетические и синтетические антибиотики
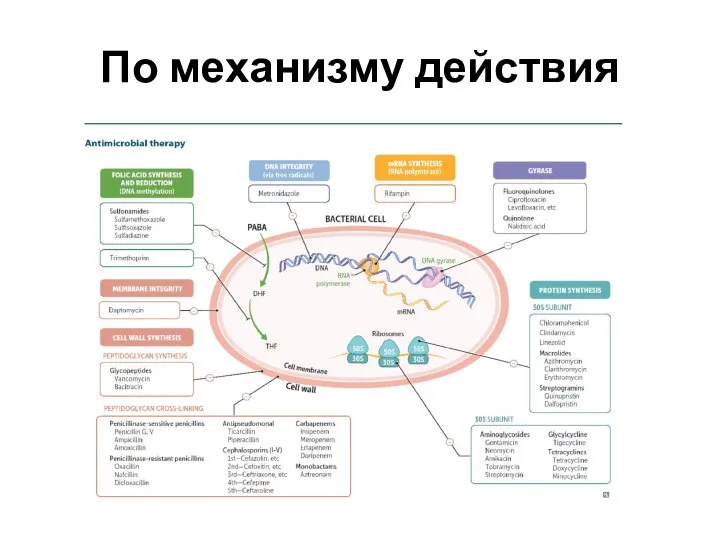
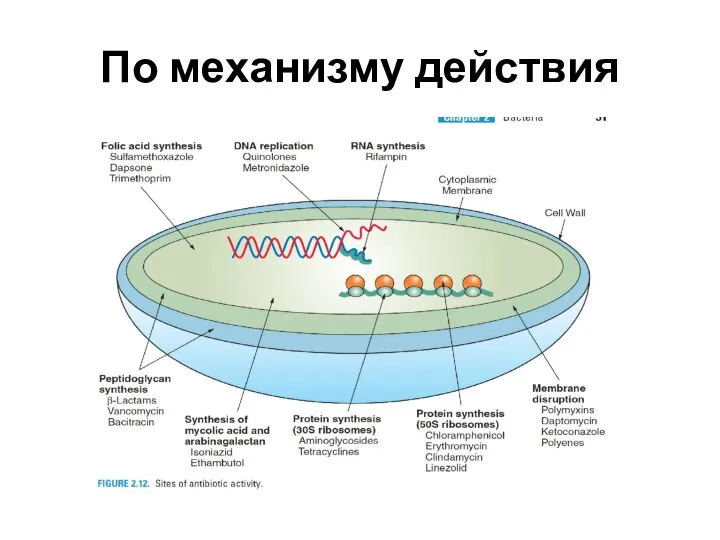
Слайд 6По механизму действия
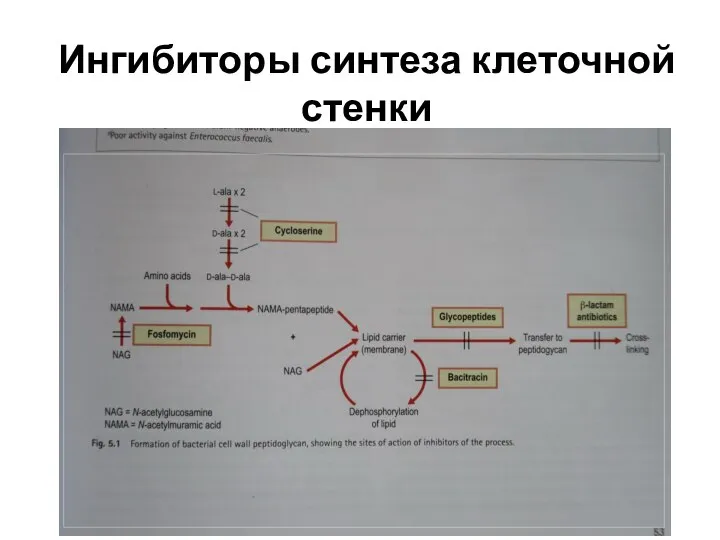
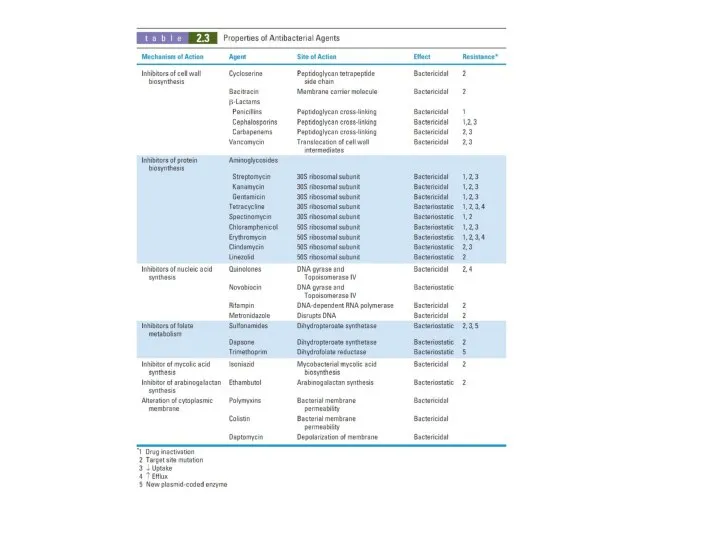
Ингибиторы синтеза клеточной стенки
Ингибиторы синтеза белка
Ингибиторы синтеза нуклеиновой кислоты
Ингибиторы обмена

фолиевой кислоты
Ингибитор синтеза миколевой кислоты
Ингибитор синтеза арабингалактана
Повреждение цитоплазматической мембраны
Слайд 9
Ингибиторы синтеза клеточной стенки
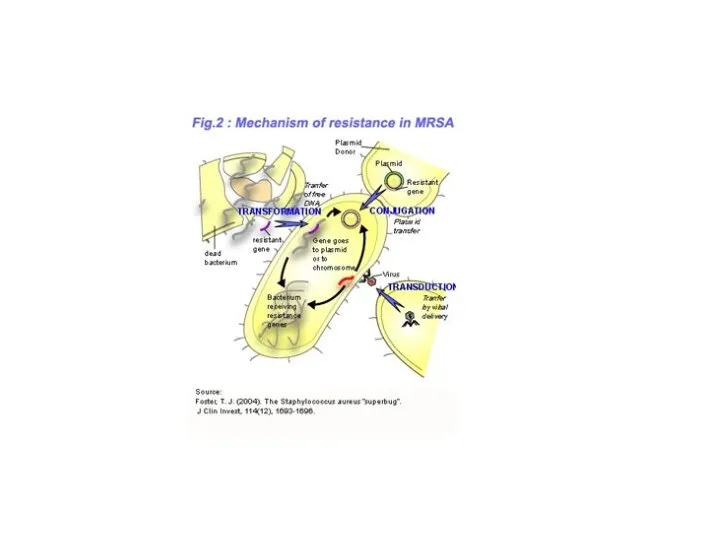
Слайд 11Механизмы развития лекарственной устойчивости
Не генетические: потеря специфических структур (например, отсутствие клеточной стенки

у L-форм бактерий)
Генетические
Хромосомные, приводящие к повреждению рецептора для лекарственного препарата или изменению прохождения лекарственного препарата
Внехромосомные
R-плазмида (кодирует ферменты, разрушающие антибиотик (β-лактамаза) или изменяющие лекарство (ацетилтрансфераза). Плазмиды могут также кодировать транспортные системы, осуществляющие активное выведение антибиотика
Слайд 12Механизмы развития лекарственной устойчивости
Известны следующие биохимические механизмы устойчивости бактерий к антибиотикам:
Модификация мишени

действия
Инактивация антибиотика
Активное выведение антибиотика из микробной клетки (эффлюкс)
Нарушение проницаемости внешних структур микробной клетки
Формирование метаболического "шунта"
Слайд 13 1. Модификация мишени действия
Основной мишенью действия макролидов, кетолидов и линкозалидов является

50S субъединица бактериальной рибосомы. У большинства бактерий устойчивость возникает в результате метилирования 23S-субъединицы рРНК
Ведущим механизмом устойчивости к хинолонам/фторхинолонам является модификация мишеней - двух бактериальных ферментов ДНК-гиразы и топоизомеразы IV, опосредующих конформационные изменения в молекуле бактериальной ДНК, необходимые для ее нормальной репликации
Слайд 142. Инактивация антибиотика
гидролиз одной из связей β-лактамного кольца ферментами β-лактамазами
Ферменты, инактивирующие макролиды

и линкозамиды
Основным механизмом устойчивости к аминогликозидам является их ферментативная инактивация путем модификации
Слайд 153. Активное выведение антибиотика из микробной клетки (эффлюкс)
Активное выведение макролидов, линкозамидоов и

тетрациклинов осуществляют транспортные системы
Слайд 164. Нарушение проницаемости внешних структур микробной клетки
Проникновение аминогликозидов через внешнюю и цитоплазматическую

мембраны бактерий является сложным процессом. Низкая природная чувствительность к аминогликозидаам некоторых микроорганизмов (например, Burkholderia cepacia) связана именно с недостаточной проницаемостью для антимикробных препаратов внешней мембраны этих микроорганизмов. Их мутации, приводящие к изменению структуры липополисахарида у E.coli и P.aeruginosa, могут обусловить значительное повышение устойчивости к аминогликозидамам
Природная устойчивость к аминогликозидам анаэробов объясняется тем, что транспорт этих антибиотиков через цитоплазматическую мембрану связан с системами переноса электронов, которые у анаэробов отсутствуют. По этой же причине факультативные анаэробы в условиях анаэробиоза, становятся значительно более устойчивыми к аминогликозидам, чем в аэробных условиях
Практически важным фактом является природная устойчивость к аминогликозидам стрептококков и энтерококков, связанная с преимущественно анаэробным метаболизмом этих бактерий и, соответственно, невозможностью транспорта антибиотиков к чувствительным мишеням. При совместном воздействии на микробную клетку аминогликозидов и β-лактамов последние нарушают структуру цитоплазматической мембраны бактерий и облегчают транспорт аминогликозидов. В результате этого между β-лактамами и аминогликозидами проявляется выраженный синергизм
Слайд 175. Формирование метаболического "шунта"
Резистентность к триметоприму может являться результатом приобретения генов дигидрофолатредуктазы,
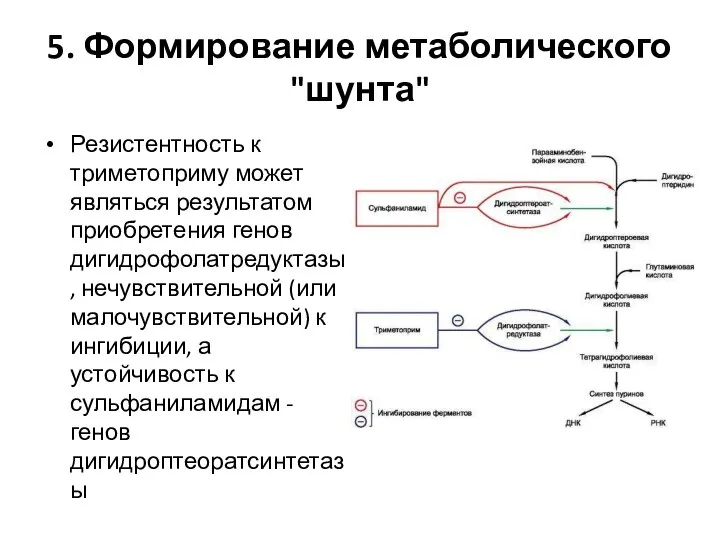
нечувствительной (или малочувствительной) к ингибиции, а устойчивость к сульфаниламидам - генов дигидроптеоратсинтетазы
Слайд 18Преодоление лекарственной устойчивости
соблюдение принципов рациональной химиотерапии
создание новых химиотерапевтических средств, отличающихся механизмом антимикробного

действия и мишенями
постоянная ротация (замена) используемых в данном лечебном учреждении или на определенной территории химиопрепаратов (антибиотиков)
комбинированное применение бета-лактамных антибиотиков совместно с ингибиторами бета-лактамаз (клавулановая кислота, сульбактам, тазобактам)
Слайд 19Принципы рациональной антимикробной терапии
Антимикробная терапия должна назначаться строго по показаниям (т. е.

только в тех случаях, когда без нее нельзя обойтись) и с учетом противопоказаний (например повышенной чувствительности или аллергической реакции к препаратам той или иной группы)
Выбор препарата для химиотерапии может проводиться в различных вариантах;
при этиологически расшифрованных заболеваниях выбор препарата должен определяться с учетом чувствительности возбудителя (антибиотикограмма), выделенного от данного конкретного больного в результате бактериологического исследования; при выделении возбудителя без определения его чувствительности к химиопрепаратам или при эмпирической инициальной химиотерапии заболевания с неидентифицированным, но предполагаемым возбудителем выбор препарата для химиотерапии должен основываться на показателях антибиотикочувствительности соответствующих микроорганизмов — наиболее вероятных возбудителей данной нозологической формы заболевания по данным литературы или при ориентации на данные о региональной чувствительности тех или иных инфекционных агентов — возбудителей данного заболевания
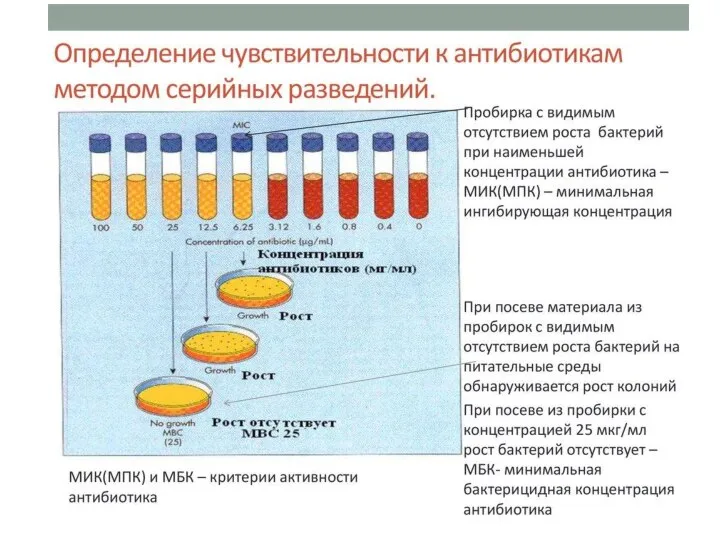
лечение должно проводиться строго по схеме, рекомендованной для выбранного химиопрепарата (способ и кратность введения препарата, длительность лечения), а также с учетом коэффициента увеличения концентрации препарата в целях создания эффективных концентраций препарата непосредственно в органах и тканях (примерно 4 МПК — минимальная подавляющая концентрация, определенная методом серийных разведений)
длительность приема химиопрепаратов должна составлять, как минимум, 4—5 дней в целях профилактики формирования устойчивости возбудителя к данному препарату, а также формирования бактерионосительства (при дерматомикозе, кандидозе и трихомониазе влагалища с целью предупреждения рецидивов лечение продолжают в течение 2—4 недель после исчезновения симптомов заболевания)
Слайд 20Осложнения антимикробной терапии
Общие (крапивница, анафилактичесий шок, ангионевротический отек, дисбактериоз)
Местные (гиперемия в месте

инъекции)
Слайд 21Определение чувствительности к антибиотикам
Диффузионные методы
с использованием дисков с антибиотиками
с помощью Е-тестов
Методы

разведения
разведение в жидкой питательной среде (бульоне)
разведение в агаре
Слайд 22Диффузионные методы
Диски с антибиотиками
Количественный Е-тест




















 Пищевые отравления
Пищевые отравления Страшная плата за страшный миг радости
Страшная плата за страшный миг радости Радиово́лны
Радиово́лны Экзоскелет в медицине
Экзоскелет в медицине Травмы конечностей
Травмы конечностей Реакция агглютинации и её варианты
Реакция агглютинации и её варианты Система обработки изображений в медицине
Система обработки изображений в медицине ЖКТ
ЖКТ Эфферентная иннервация. Адренергия
Эфферентная иннервация. Адренергия Опийный мак как лекарственное сырье
Опийный мак как лекарственное сырье Галактоземия
Галактоземия Современная медицина
Современная медицина Укрепляй иммунитет
Укрепляй иммунитет Острый коронарный синдром. Этиология, патогенез, клинические проявления, диагностика
Острый коронарный синдром. Этиология, патогенез, клинические проявления, диагностика Школа безопасности. Оказание помощи при кровотечении
Школа безопасности. Оказание помощи при кровотечении Паттерны контрастного усиления при МРТ и КТ исследовании головного и спинного мозга
Паттерны контрастного усиления при МРТ и КТ исследовании головного и спинного мозга Ларинготрахеит у детей
Ларинготрахеит у детей Аминохинолиновые производные
Аминохинолиновые производные Эпидемиология. Кандидоз
Эпидемиология. Кандидоз Проблемы здоровья и долголетия. Маникюр
Проблемы здоровья и долголетия. Маникюр Аритмии у детей
Аритмии у детей RAZVITIE_OTEChESTVENNOJ_TERAPII
RAZVITIE_OTEChESTVENNOJ_TERAPII Врачевание в Древней Месопотамии
Врачевание в Древней Месопотамии Рецептурa
Рецептурa Пузырные дерматозы
Пузырные дерматозы Воспалительные заболевания матки
Воспалительные заболевания матки Энтероцеллюлярная мальабсорбция с нарушением мембранного пищеварения и всасывания
Энтероцеллюлярная мальабсорбция с нарушением мембранного пищеварения и всасывания Оценка эффективности применения шелка по сравнению с викрилом для закрытия срединных брюшных разрезов
Оценка эффективности применения шелка по сравнению с викрилом для закрытия срединных брюшных разрезов