Содержание
- 2. ПЛАН ЛЕКЦИИ I. Источники аммиака в клетках. II. Причины токсичности аммиака. III. Первичное обезвреживание аммиака в
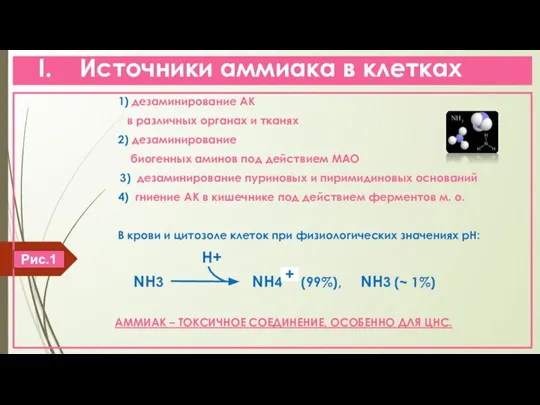
- 3. I. Источники аммиака в клетках 1) дезаминирование АК в различных органах и тканях 2) дезаминирование биогенных
- 4. II. Причины токсичности аммиака: 1. Высокое содержание NH3 в тканях количество α-кетоглутарата (α-КГ), т. к. он
- 5. II. Причины токсичности аммиака 3. [ ГЛУ ] снижает синтез ГАМК, нарушается проведение нервного импульса, повышается
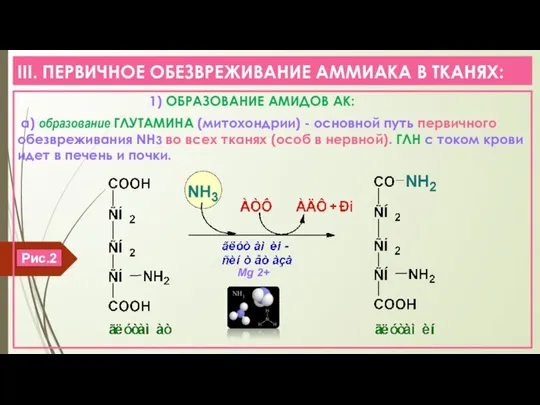
- 6. III. ПЕРВИЧНОЕ ОБЕЗВРЕЖИВАНИЕ АММИАКА В ТКАНЯХ: 1) ОБРАЗОВАНИЕ АМИДОВ АК: а) образование ГЛУТАМИНА (митохондрии) - основной
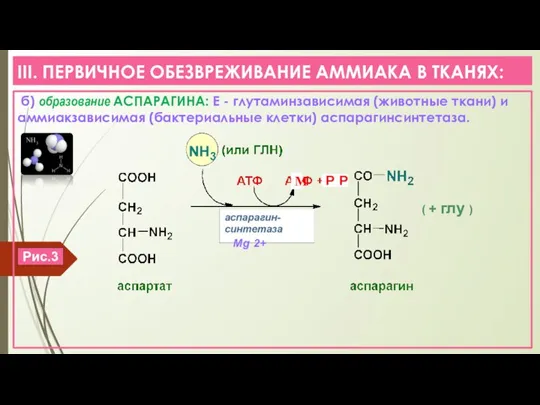
- 7. III. ПЕРВИЧНОЕ ОБЕЗВРЕЖИВАНИЕ АММИАКА В ТКАНЯХ: б) образование АСПАРАГИНА: Е - глутаминзависимая (животные ткани) и аммиакзависимая
- 8. III. ПЕРВИЧНОЕ ОБЕЗВРЕЖИВАНИЕ АММИАКА В ТКАНЯХ: 2) ВОССТАНОВИТЕЛЬНОЕ АМИНИРОВАНИЕ (мозг и др. ткани): α-КГ + NH3
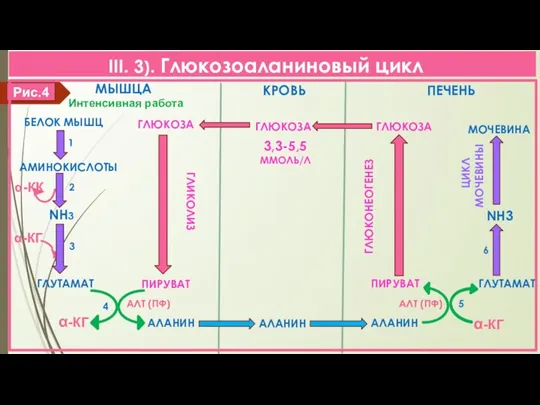
- 9. III. 3). Глюкозоаланиновый цикл α-КГ α-КК Интенсивная работа 1 Рис.4 КРОВЬ МЫШЦА ПЕЧЕНЬ БЕЛОК МЫШЦ ГЛЮКОЗА
- 10. III. 3). Глюкозоаланиновый цикл 1. Распад белков мышц/интенсивная мышечная работа 2. Дезаминирование АК/энергия 3. Восстановительное аминирование
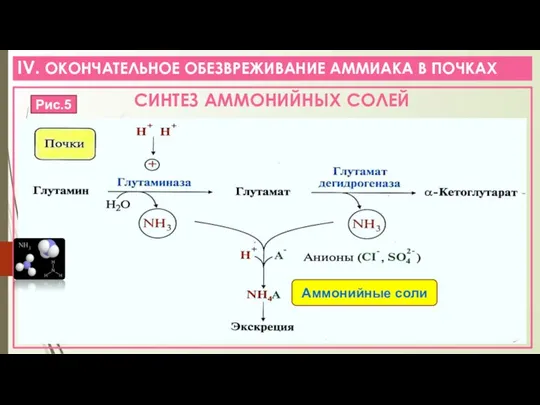
- 11. IV. ОКОНЧАТЕЛЬНОЕ ОБЕЗВРЕЖИВАНИЕ АММИАКА В ПОЧКАХ СИНТЕЗ АММОНИЙНЫХ СОЛЕЙ Рис.5 Аммонийные соли
- 12. IV. ОКОНЧАТЕЛЬНОЕ ОБЕЗВРЕЖИВАНИЕ АММИАКА В ПОЧКАХ РОЛЬ ОБРАЗОВАНИЯ СОЛЕЙ АММОНИЯ: в виде СОЛЕЙ АММОНИЯ с мочой
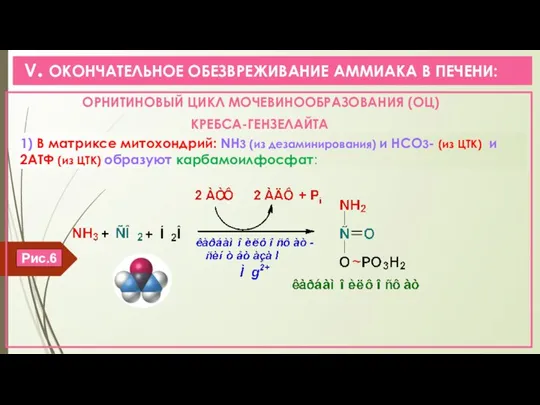
- 13. V. ОКОНЧАТЕЛЬНОЕ ОБЕЗВРЕЖИВАНИЕ АММИАКА В ПЕЧЕНИ: ОРНИТИНОВЫЙ ЦИКЛ МОЧЕВИНООБРАЗОВАНИЯ (ОЦ) КРЕБСА-ГЕНЗЕЛАЙТА 1) В матриксе митохондрий: NH3
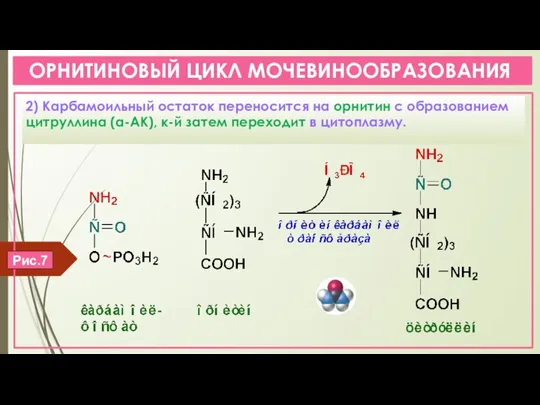
- 14. ОРНИТИНОВЫЙ ЦИКЛ МОЧЕВИНООБРАЗОВАНИЯ 2) Карбамоильный остаток переносится на орнитин с образованием цитруллина (α-АК), к-й затем переходит
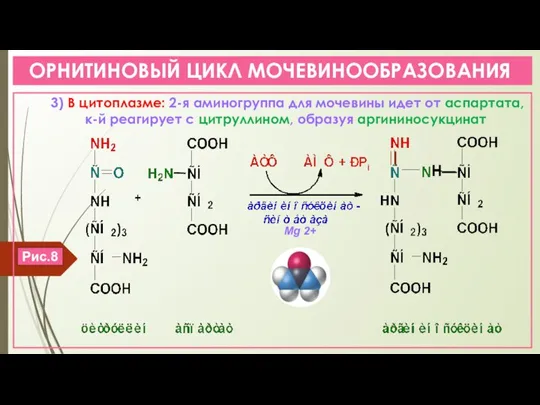
- 15. ОРНИТИНОВЫЙ ЦИКЛ МОЧЕВИНООБРАЗОВАНИЯ 3) В цитоплазме: 2-я аминогруппа для мочевины идет от аспартата, к-й реагирует с
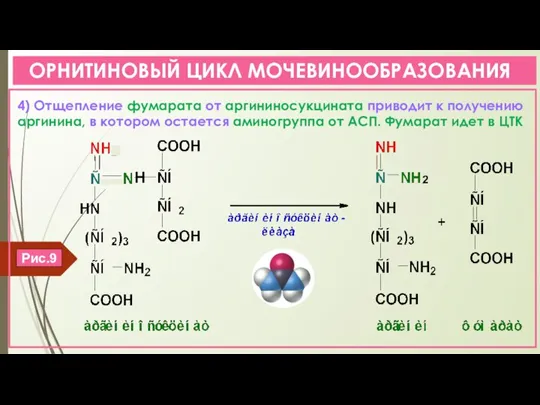
- 16. ОРНИТИНОВЫЙ ЦИКЛ МОЧЕВИНООБРАЗОВАНИЯ 4) Отщепление фумарата от аргининосукцината приводит к получению аргинина, в котором остается аминогруппа
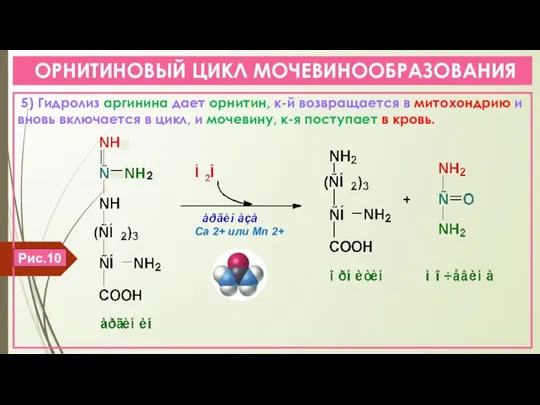
- 17. ОРНИТИНОВЫЙ ЦИКЛ МОЧЕВИНООБРАЗОВАНИЯ 5) Гидролиз аргинина дает орнитин, к-й возвращается в митохондрию и вновь включается в
- 18. VI. Б/РОЛЬ и нарушения работы ОЦ 1) РОЛЬ ОЦ: Синтез мочевины - окончательное обезвреживание аммиака Синтез
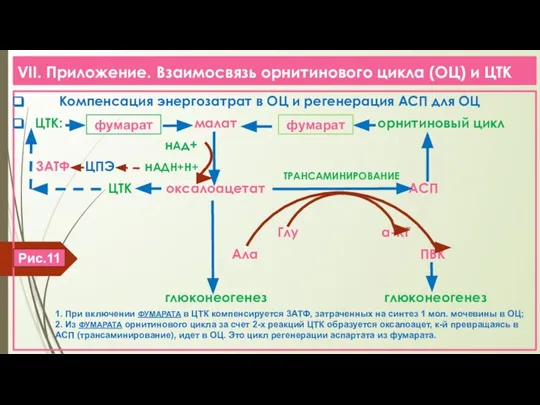
- 19. VII. Приложение. Взаимосвязь орнитинового цикла (ОЦ) и ЦТК Компенсация энергозатрат в ОЦ и регенерация АСП для
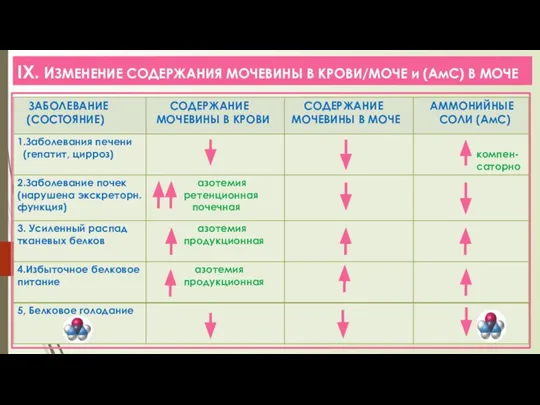
- 20. VIII. Остаточный АЗОТ крови / АЗОТемия 1. Из крови мочевина поступает в почки и выводится с
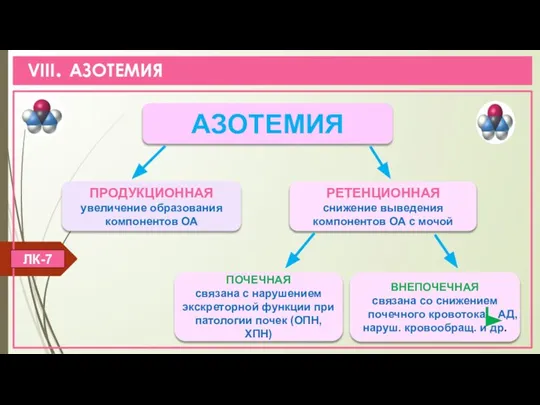
- 21. VIII. АЗОТЕМИЯ ЛК-7 ПОЧЕЧНАЯ связана с нарушением экскреторной функции при патологии почек (ОПН, ХПН) АЗОТЕМИЯ ПРОДУКЦИОННАЯ
- 22. IX. ИЗМЕНЕНИЕ СОДЕРЖАНИЯ МОЧЕВИНЫ В КРОВИ/МОЧЕ и (АмС) В МОЧЕ
- 23. X. ИЗМЕНЕНИЕ СОДЕРЖАНИЯ КОМПОНЕНТОВ ОА В КРОВИ
- 24. X. ИЗМЕНЕНИЕ СОДЕРЖАНИЯ КОМПОНЕНТОВ ОА В КРОВИ
- 25. XI. СПИСОК ЛИТЕРАТУРЫ Основная литература Биохимия: учебник/ под ред. Е.С. Северина.- М.: ГЭОТАР- Медиа, 2011. -
- 27. Скачать презентацию


![II. Причины токсичности аммиака 3. [ ГЛУ ] снижает синтез ГАМК, нарушается](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1062430/slide-4.jpg)








 Внелегочные осложнении пневмонии
Внелегочные осложнении пневмонии Имплантация. История и определение, виды имплантатов в МД, их особенности, подготовка и процесс установки
Имплантация. История и определение, виды имплантатов в МД, их особенности, подготовка и процесс установки Гормоны поджелудочной железы
Гормоны поджелудочной железы Аллергические реакции и токсическое воздействие частичных съемных протезов
Аллергические реакции и токсическое воздействие частичных съемных протезов Вольфартиоз. Вольфартовая муха
Вольфартиоз. Вольфартовая муха Нарушения осанки
Нарушения осанки Стриопаллидарная система
Стриопаллидарная система Стоматогенный очаг инфекции. Очагово-обусловенные заболевания
Стоматогенный очаг инфекции. Очагово-обусловенные заболевания Методы обследования беременных
Методы обследования беременных Травма – основная причина смерти в популяции
Травма – основная причина смерти в популяции Первая помощь при повреждениях опорно-двигательной системы
Первая помощь при повреждениях опорно-двигательной системы Гипогликемия. Эпидемиология, классификация, этиология, патогенез и лечение
Гипогликемия. Эпидемиология, классификация, этиология, патогенез и лечение Фитотеpапия в гинекологии
Фитотеpапия в гинекологии 2021_Afanaseva_GA_vospalenie_1_
2021_Afanaseva_GA_vospalenie_1_ Первая медицинская помощь при неотложных состояниях. 7 класс
Первая медицинская помощь при неотложных состояниях. 7 класс Полноценная тарелка
Полноценная тарелка Аппендицит и гинекологические заболевания
Аппендицит и гинекологические заболевания Право на бесплатную медицинскую помощь
Право на бесплатную медицинскую помощь Сыпи у детей (1)
Сыпи у детей (1) Особенности ЛФК при гипертонической болезни
Особенности ЛФК при гипертонической болезни Целиакия
Целиакия Дарыу үләндәре
Дарыу үләндәре Жевательная резинка: польза или вред для зубов?
Жевательная резинка: польза или вред для зубов? Созылмалы бүйрек ауруларының үдеу механизмі
Созылмалы бүйрек ауруларының үдеу механизмі Автоматизированные системы. Умная медицина. Робот Da Vinci
Автоматизированные системы. Умная медицина. Робот Da Vinci Иридодиагностика. Проекционная зона
Иридодиагностика. Проекционная зона Расчёт СКФ. Проба Реберга
Расчёт СКФ. Проба Реберга фелинотерапия. Функции фелинотерапии
фелинотерапия. Функции фелинотерапии